 |
 |
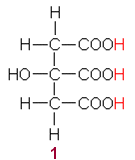
Happamat vetyatomit merkitty punaisella. 1
sitruunahappo 2
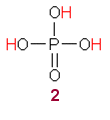
ortofosforihappo |
Kalsium karbonaatti (kalkkikivi) CaCO3 on lievästi emäksistä (miksi?). Sitruunahapon anionit voivat muodostaa Ca2+-ionien kanssa saostuman emäksisessä liuoksessa, jossa on ylimäärin kalsiumioneja. Neutraalissa ja happamassa liuoksessa saostumaa ei muodostu.
 |
 |
Happamat vetyatomit merkitty punaisella. 1
sitruunahappo 2
ortofosforihappo |
Fosfaattien liukoisuudesta
Jos ihmettelit fosforihapon
käyttöä ja muistit, että luustossa on kalsiumfosfaatteja,
niin ehkäpä seuraavat tiedot selventävät asiaa.
Ca3(PO4)2 saostuu voimakkaasti
emäksisistä liuoksista. Lähes neutraalissa liuoksessa saostuu
CaHPO4. Nämä fosfaatit liukenevat laimeisiin happoihin.
Luukudoksessa on hydroksiapatiittia eli
Ca5(PO4)3OH. Sen liukoisuutta
miettiessäsi, muistapa hampaisiin kohdistuvien
"happohyökkäysten" seurauksia.