Typpiatomilla on 5 elektronia uloimmalla elektronikuorella. Kumpikin atomi käyttää sidoksen muodostamiseen 3 elektronia ja kummallekin atomille jää näin ollen vapaa elektronipari. N2 on symmetrinen ja pooliton.
1 | 2 | 3 | 4 | 5 | 6 | 7 | +8 | kysymykset (erilliseen selainikkunaan)
a) Kullassa on metallisidos. Sidoksen muodostuessa kulta-atomit järjestäytyvät säännölliseksi hilaksi. Ne luovuttavat uloimmat elektroninsa yhteiseen käyttöön, jolloin positiivisten metalli-ionien välisessä "elektronimeressä" on vapaasti liikkuvia elektroneja. Hilan atomit voivat liukua paikoiltaan sidoksen katkeamatta hilassa vaeltavien elektronien ansiosta. Kulta on raskas metalli, jolla elektroneja on suhteellisen paljon, mikä vaikuttaa sidoksen kestävyyteen. b) Jään tiheys on pienempi kuin nestemäisen veden tiheys, koska jäässä on pysyvä kidehila, jossa vesimolekyylit ovat sijoittuneet säännölliseen järjestykseen kauemmas toisistaan kuin nestemäisessä vedessä. Molemmissa olomuodoissa vesimolekyylien välillä on vetysidoksia, mutta nestemäisessä olomuodossa sidokset ajoittain katkeilevat ja muodostuvat uudelleen. Vesimolekyylien etäisyys toisistaan siis vaihtelee. c) Ilmassa typpi on N2-molekyyleinä. Typpimolekyylissä on typpiatomien välillä luja kolmoissidos (sidosenergia 944 kJ/mol, pituus 110 pm).
|
Typpiatomilla on 5 elektronia uloimmalla elektronikuorella. Kumpikin atomi käyttää sidoksen muodostamiseen 3 elektronia ja kummallekin atomille jää näin ollen vapaa elektronipari. N2 on symmetrinen ja pooliton. |
a) C 82,7 % ja H 100 % – 82,7 % = 17,3 %
Lasketaan ainemäärät oletetussa 100 g:n
näytteessä.
n(H) = 17,3 g : 1,01 g/mol = 17,1
mol
n(C) = 82,7 g : 12,0 g/mol = 6,89 mol
n(C)
: n(H) = 6,89 : 17,1 = 1 : 2,5 = 2 : 5
Empiirinen kaava on k(C2H5)
Kerroin k ei voi olla pariton luku, koska hiilivedyssä on aina parillinen määrä H-atomeja. Jos k on 2, saadaan molekyylikaavaksi C4H10. Jos k on 4 tai sitä suurempi parillinen luku, vetyatomeja tulee kaavaan liikaa (esim. C8H20 on mahdoton, tyydyttyneen 8-hiilisen hiilivedyn kaava olisiC8H18).
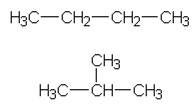
b) Molekyylikaavaa C4H10 vastaa kaksi rakennetta. ylempi on butaani, alempi metyylipropaani.
a) Kalsium- ja magnesiumkarbonaatin hajoamista kuumennettaessa kuvaavat reaktioyhtälöt:
CaCO3(s) → CaO(s) + CO2(g)
MgCO3(s)
→ MgO(s) + CO2(g)
b) Merkitään x = m(MgCO3)
n(CaCO3) = (0,876 g – x) : 100,09 g/mol =
n(CaO)
m(CaO) = n(CaO) ·
M(CaO)
m(CaO) = [(0,876 g – x) : 100,09
g/mol] · 56,08 g/mol
m(CaO) = 0,4908 –
0,5603x
n(MgO) = n(MgCO3)
n(MgO) = x : 84,32 g/mol
m(MgO) = n(MgO)
· M(MgO) = ( x : 84,32 g/mol)
· 40,31 g/mol =i 0,4781x
Jäännös 0,477
g = m(MgO) + m(CaO)
Ratkaistaan siis yhtälö:
0,4908 – 0,5603x + 0,4781x = 0,477 ja saadaan x =
0,1678 (g)
MgCO3:n osuus prosentteina: 100 ·
0,1678 : 0,876 % = 19,2 %
Etanolin (CH3CH2OH) valmistus
1. Valmistus käymisreaktiolla
Glukoosi ja
fruktoosi käyvät hiivan entsyymien vaikutuksesta etanoliksi, kun
happea ei päästetä käymisseokseen. Samalla syntyy
hiilidioksidia.
Sakkaroosi, maltoosi ja tärkkelys (vilja, peruna) on hajotettava ensin esim. entsymaattisesti glukoosiksi, jos niitä käytetään etanolin valmistukseen. Käymisessä ei saada 20-prosenttista väkevämpiä etanoliliuoksia. Jos halutaan väkevämpi liuos, on etanoli tislattava. Vesi ja etanoli muodostavat atseotrooppisen seoksen (kp. 68 °C), joten puhtaan etanolin valmistus tislaamalla on vaikeaa. Hapen läsnä ollessa etanoli käy etikaksi CH3COOH(aq).
2. Etanolin synteettinen valmistus
Etanolia syntyy
eteenin ja veden additioreaktiossa. (Reaktiossa tarvitaan katalyytti.)
Etanolin käyttö
Etanolin reaktiot
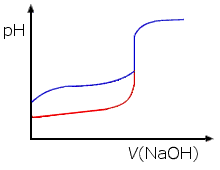
b) Etikkahapon (CH3COOH) titrauksessa syntyy puskuriliuos, sillä etikkahappo on heikko happo, jonka anioni hydrolysoituu tuottaen etikkahappoa ja hydroksidi-ioneja.
c) Vahvan hapon HNO3 titrauksessa ekvivalenttikohta on pH-arvossa 7. Heikkoa happoa titrattaessa ekvivalenttikohdan pH:ksi tulee on suurempi arvo kuin 7 puskurivaikutuksen (ja/tai hydrolyysin) takia.
d) Kun ekvivalenttikohta on ohitettu, liuos on emäksinen vahvan emäksen NaOH vaikutuksesta. Kumpikin happo on täydellisesti neutraloitunut.
a) Ruokasuola on ioniyhdiste NaCl, jonka kidehila purkautuu ioneiksi suolan liuetessa veteen. Ionit hydratoituvat. Vrt. tehtävään yo s01/1
b) Natrium reagoi veden kanssa, jolloin syntyy emäksinen NaOH-liuos ja vapautuu vetykaasua. Reaktiossa natrium hapettuu, ja vety pelkistyy.
c)Sinkkimetallijauhe reagoi suolahapon kanssa. Reaktiossa vapautuu vetyä ja syntyy Zn2+-ioneja. Sinkki hapettuu, ja vety pelkistyy.
d) Hopea pelkistyy (syntyy saostuma) ja Fe2+ hapettuu Fe3+:ksi.
e) Ei tapahdu reaktiota, koska hopea on jalompi metalli kuin kupari. Kupari pysyy ioneina ja hopea metallisena.
f) Bromi Br2 pelkistää jodidi-ionin. Kloridi-ioni ei reagoi. Reaktioseos värjäytyy ruskeaksi. Koska bromi on ruskeaa, värinmuutos on epäselvä. (Jodin violetti väri tulee näkyviin, jos seokseen lisätään esim. hiilitetrakloridia, johon jodi liukenee.)
a) Magnesiumhydroksidin Mg(OH)2 liukoisuus veteen tarkoittaa magnesiumhydroksidin määrää (massaa), joka muodostaa kylläisen liuoksen. Liukoisuus ilmoitetaan esim. g/l tai g/dm3. Liukoisuus riippuu lämpötilasta.
b) Magnesiumhydroksidin liukoisuustulo on [Mg2+] · [OH– ]2 = 1,1 · 10 –11 (mol/l)3 Liukoisuustulo on liukenemisen (faasitasapainon) tasapainovakio. [Mg2+] ja [OH– ] tarkoittavat kylläisen liuoksen ko. ionien konsentraatioita. Liukoisuustulon arvo (pieni!) kertoo, että magnesiumhydroksidi on niukkaliukoinen yhdiste.
c) Valmistetaan Mg(OH)2:n kylläinen liuos, liuottamalla yhdistettä kuumaan veteen ja antamalla liuoksen jäähtyä. Kylläisessä liuoksessa on pohjalla kiinteä faasi. Suodatetaan liuos ja otetaan suodoksesta näytteitä, joista määritetään c(Mg2+) spektrometrisesti. Määritettäessä c(OH –) titraamalla jäisi hapon kulutus aika pieneksi.