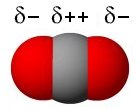
Molekyylimalli
1 | 2 | 3 | 4 | 5 | 6 | 7 | +8 | kysymykset (erilliseen selainikkunaan)
Väitteiden kemialliset perustelut
a) Fossiiliset polttoaineet on peräisin hiilikerrostumista, maaöljystä ja maakaasusta, jotka ovat syntyneet syvälle maakerrosten väliin muinoin kuolleiden kasvien ja eläinten jäännöksistä Fossiiliset polttoaineet sisältävät hiiltä ja sen yhdisteitä, pääosin hiilivetyjä , joiden palaessa syntyy hiilidioksidia CO2. Poltettaessa hiili vapautuu siis pitkäaikaisvarastoistaan kiertoon ja ilmakehän CO2-pitoisuus kasvaa, ellei hiilidioksidia sitoudu riittävässä määrin vesistöihin (lähinnä meriin sekä sadeveteen) ja vihreisiin kasveihin. CO2 ei nesteydy normaalipaineessa eikä voi siis poistua ilmakehästä muuten kuin liukenemalla veteen (tapahtuu myös protolyysireaktio, c-kohta!) tai osallistumalla yhteyttämisreaktioihin.
b) Sadeveden happamuus johtuu osittain hiilidioksidista, mutta sadevettä happamoittavat lisäksi rikin ja typen oksidit, joista pääsee ilmakehään mm. vulkaanisen toiminnan seurauksena sekä fossiilisia polttoaineita poltettaessa ja teollisista prosesseista. Sadeveden luonnollinen pH on noin 6, mutta asutuilla seuduilla pH voi laskea jopa arvoihin 4 – 5. Usein hiilidioksidista johtuvaa sadeveden happamuutta nimitetään " luonnolliseksi happamuudeksi" ja muiden happamoittavien aineiden yhteydessä puhutaan "happamasta laskeumasta".
tai
c) Vihreät kasvit käyttävät hiilidioksidia yhteyttämisreaktioon, joten ne kuluttavat ilmasta hiilidioksidia, mutta hiilen kiertokulusta johtuen ilmakehän CO2-pitoisuus ei varsinaisesti vähene vaan pysyy jokseenkin vakiona. Tosin viime vuosisadan aikana ilman CO2-pitoisuus on kohonnut, minkä arvellaan johtuvan ihmisten toiminnasta, mm. teollisuuden ja liikenteen kasvusta. Toisaalta metsäalueet ja muut hiilidioksidia tehokkaasti kuluttavat alueet ovat pienentyneet, nekin pääosin ihmisen toimesta.
d) Normaaliolosuhteet (NTP): T = 273 K (0 °C),
p = 1,013 bar
CO2 muuttuu normaalipaineessa
kiinteäksi lämpötilassa 194,5 K
 |
| O=C=O Molekyylimalli |
Hiilidioksidin molekyylirakenne on sauvamainen ja symmetrinen, joten molekyyli on pooliton. Heikohkot dispersiovoimat (Londonin voimat, van der Waalsin voimat) ovat siten hallitsevia molekyylien välisessä vuorovaikutuksessa. Tämä ei kuitenkaan riitä täysin selittämään hiilidioksidin ominaisuuksia — vaikkakin auttaa ymmärtämään yhdisteen olomuodon normaaliolosuhteiden lähellä.
Neutraloitumisreaktion yhtälö:
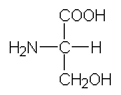
Hiilen, vedyn, typen ja hapen prosenttiosuuksien summa (34,3 + 6,7 + 13,3 + 45,7) % = 100 %, joten yhdisteessä ei ole muita alkuaineita.
a) Lasketaan kunkin alkuaineen ainemäärä oletetussa 100 g:n näytteessä.
| Aine | C | H | N | O |
| % | 34,3 | 6,7 | 13,3 | 45,7 |
| m (g) | 34,3 | 6,7 | 13,3 | 45,7 |
| M (g/mol) | 12,01 | 1,01 | 14,01 | 16,00 |
| n (mol) | 2,86 | 6,63 | 0,95 | 2,86 |
| n(C) : n(H) : n(N) : n(O) = 2,86 : 6,63 : 0,95 : 2,86 = 3 : 7 : 1 : 3 | ||||
Empiirinen kaava on k(C3H7O3N ).
b) Yhdisteen suhteellinen molekyylimassa on 105.
Kaavasta
laskemalla saadaan suhteelliseksi molekyylimassaksi
3 · 12,0
+ 7 · 1 + 3 · 16,0 + 14,0 = 105
kun kerroin k on
1.
Yhdisteen molekyylikaava on siis
C3H7O3N
c) Koska yhdiste on luonnossa yleisesti esiintyvä aminohappo, se ilmeisesti sisältää karboksyyliryhmän ja aminoryhmän, jotka kiinnittyvät samaan hiiliatomiin. Sivuketjuun jää täten yksi hiiliatomi ja hydroksyyliryhmä.
Atomin elektronirakenteeseen liittyvät käsitteet
a) Paulin periaate
(kieltosääntö)
Jokaisella saman atomin elektronilla on
erilainen kvanttilukuyhdistelmä: ainakin yksi kvanttiluku on siis
poikkeava.
b) Hundin sääntö
Jokaisen
elektronikuoren samannimisiin orbitaaleihin asettuvat ensin parittomat
elektronit. Kuhunkin orbitaaliin voi kuulua korkeintaan kaksi elektronia,
joiden spinkvanttiluvut ovat vastakkaiset. Spinkvanttiluku kuvaa elektronin
oman akselinsa ympäri tapahtuvan pyörimisen suuntaa. Spinkvanttiluvut
ovat +1/2 (nuoli ylös) ja –1/2 (nuoli alas).
c) Elektronikuori
Elektronit muodostavat atomiytimen
ympärille elektronipilven, jossa elektronit esiintyvät energialtaan
erilaisilla energiatasoilla, jotka ryhmitellään karkeasti
elektronikuoriksi. Ensimmäinen elektronikuori on lähinnä
ydintä ja energialtaan pienin. Elektronikuoret on nimetty isoilla
kirjaimilla K, L, M, ... Erilaisten hyppäyksittäin muuttuvien
energiatasojen esiintyminen on osoitus energian kvantittumisesta. Kirjaimiin
liitetään pääkvanttiluku seuraavasti K 1, L 2, M 3 jne.
Kullekin kuorelle mahtuu vain tietty määrä elektroneja,
K-kuorelle 2 , L-kuorelle 8, M-kuorelle 18 eli 2n2 elektronia.
Kaavassa n tarkoittaa pääkvanttilukua. Elektronikuoren käsite
syntyi Bohrin atomimallin myötä.
d) s-orbitaali
Orbitaali on atomiin tai molekyyliin
sisältyvä alue, jolla elektroni todennäköisimmin
liikkuu. Todennäköisyyttä käytetään, koska
elektronin täsmällistä sijaintia on mahdoton
määrittää. Yhdelle orbitaalille voi sijoittua korkeintaan
kaksi elektronia eli elektronipari, jonka elektroneilla on vastakkainen spin.
Samalla elektronikuorella voi olla elektroneja, joiden energiataso on hieman
erilainen. Elektronien sanotaan silloin sijoittuvan ei orbitaaleille. Esim.
K-kuorella on vain s-orbitaali, L-kuorella s- ja p-orbitaaleja.
Orbitaalin muoto ja koko lasketaan Schrödingerin aaltoyhtälön pohjalta. Kaikki s-orbitaalit ovat kuoren matalaenergiasimpia ja muodoltaan pallomaisia. 1s-orbitaalissa ei ole solmupintaa, mutta 2s-orbitaalissa ja sitä korkeammissa on solmupinta pallon sisällä. Orbitaalin koko kasvaa päävanttiluvun mukaan.
Orbitaalia ei voida kokeellisesti havaita. Elektronitiheys sen sijaan voidaan mitata. Suuri elektronitiheys jossakin atomin tai molekyylin osassa merkitsee suurta elektronin esiintymistodennäköisyyttä.
e) Siirtymäalkuaine
on alkuaine, jonka uloimmalle
kuorelle on sijoittunut elektroneja vaikka sisempi kuori ei ole vielä
kokonaan täynnä. Siirtymäalkuaineet kuuluvat jaksollisessa
järjestelmässä d- ja f-lohkoon. Siirtymäalkuaineet ovat
kaikki metalleja.
f) Kvanttiluku
kuvaa atomin elektroniverhon rakennetta:
pääkvanttiluku kertoo elektronin energian suuruusluokan (vrt.
elektronikuori), sivukvanttiluku ilmaisee orbitaalityypin (s, p, d, f ),
magneettinen kvanttiluku ilmoittaa magneettikentässä olevan
elektronin energiatason ja spinkvanttiluku elektronin pyörimissuunnan
(oman akselinsa ympäri)
 |
|
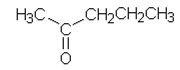
| a) 2-pentanoni | d) 1,3-butadieeni |
 |
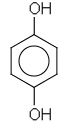 |
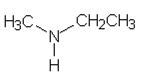
| b) etyylimetyyliamiini | e) 1,4- dihydroksibentseeni |
 |
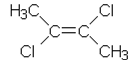 |
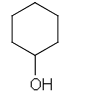
| c) sykloheksanoli | f) trans-2,3-dikloori-2-buteeni |
Yksiarvoisen hapon protolyysireaktio:
Hapon konsentraatio:
c(HA) = 2,50 mmol : 0,250 l =
0,0100 mol/l
Haposta 7,64 % on protolysoitunut, joten protolysoitumatonta
happoa on 100 % – 7,64 % = 92,36 %
Tasapainokonsentraatiot :
[HA] =
0,9236 · 0,0100 mol/l = 0,009236 mol/l
[A–] =
[ H3O+] = 0,0764 · 0,01 mol/l = 0,000764
mol/l
Happovakio Ka = [ H3O+]
· [A–] : [HA]
Ka =
(0,000764 mol/l)2 : 0,009236 mol/l = 6,32 ·
10–5 mol/l
Liuoksen pH = –log [H3O+] = –log 0,000764 = 3,12
Huomautus vastauksen tarkkuudesta: pH-arvo 3,117 tai 3,12 hyväksyttiin, pyöristyksestä arvoon 3,1 rangaistiin 1/3 pisteen menetyksellä.
|
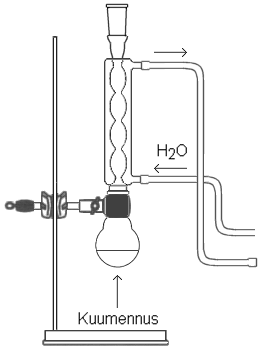
Etyylimetanaatin valmistus a) Reaktioyhtälö HCOOH +
CH3CH2OH
b) Esteröitymisreaktio on hidas. Väkevä rikkihappo toimii katalyyttinä. c) Esteröitymisreaktio on hidas, ja reaktiossa syntyy tasapainoseos. Tasapainon saavuttamiseksi tarvitaan kohtuullisen pitkä kuumennusaika. Seoksen kiehuessa osa reagensseista höyrystyy ja poistuu seoksesta pystyjäähdyttimeen, jossa höyry tiivistyy ja josta neste tippuu takaisin seokseen. Näin estetään seoksen laimeneminen ja yhdisteiden haihtuminen. d) Kiehumakivillä, jotka ovat pieniä huokoisia kiven tai posliinin palasia, estetään kiehuvan nesteen roiskuminen ja äkillinen räjähdysmäinen höyrystyminen. Ne siis tasaavat kiehumista. |
 |