1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | kysymykset (erilliseen selainikkunaan)
| Alkuaineen / ionin symboli | 3115P3– | 19679Au | 22286Rn | 5426Fe2+ |
| Protonien määrä | 15 (= 18 - 3) | 79 | 86 | 26 |
| Neutronien määrä | 16 | 117 | 136 | 28 (= 54 – 26) |
| Elektronien määrä | 18 | 79 | 86 | 24 (= 26 – 2) |
| Massaluku | 31 | 196 | 222 | 54 |
| Kokonaisvaraus | -3 | 0 | 0 | +2 |
Reaktioyhtälö
Lasketaan lähtöaineiden ainemäärät:
| Lähtöaine | m(g) | M(g/mol) | n (mol) |
| TiCl4 | 35400 | 189,69 | 35400 : 189,69 = 186,62 |
| Mg | 8300 | 24,31 | 8300 : 24,31 = 341,42 |
Reaktioyhtälön mukaan nTiCl4) = 0,5
· n(Mg)
Annetuista määristä 0,5
· 341,42 mol = 170,71 mol < n(TiCl4)
Mg:n määrä ratkaisee, kuinka paljon titaania voidaan saada.
m(Ti) = n(Ti) · M(Ti) = 170,71 mol · 47,88 g/mol = 8174 g eli 8,2 kg
a) Reaktioyhtälö:
b) Hapetuslukujen muutos
| Sn2+ hapettuu SnCl2–6 :n
Sn(IV):ksi, hapetusluku muuttuu +II →
+IV. As3+ pelkistyy alkuainearseeniksi As, hapetusluku muuttuu +III → 0. |
c) Reaktioyhtälö
Reaktioyhtälö:
Kirjoitetaan yhtälö ainemäärien perusteella (laadut
on jätetty pois luettavuuden vuoksi): juoman veden
ainemäärä + reaktiossa syntyneen veden ainemäärä
= näytteestä saadun veden ainemäärä.
Etanolia
hapettuu reaktiossa x : 46,07 moolia ja vettä muodostuu
3-kertainen ainemäärä.
Yhtälön ratkaisuksi saadaan 4,4398, joten 10,00 g:n näytteessä on alkoholia 4,440 g, mistä juoman alkoholipitoisuudeksi tulee massaprosentteina 44 %.
Huom. Moolimassojen arvo vaikuttaa laskun tulokseen selvästi. Eri taulukkokirjoissa moolimassojen arvot vaihtelevat hieman. Niinpä esim. moolimassoilla M(H2O) = 18,0152 g/mol ja M(C2H5OH) = 46,0688 g/mol saadaan tulokseksi 44,47 massaprosenttia.
MAOL :
vastauksen tarkkuudesta: vastaus 44,45 %
– 1/3 pistettä, suositeltu vastaus 44,5 % tai 44 %.
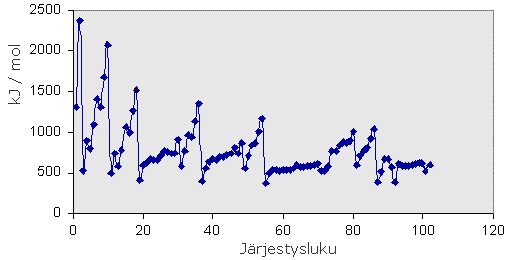
Ionisoitumisenergialla tarkoitetaan energiaa, joka tarvitaan elektronin irrottamiseen perustilaisesta atomista (kaasutilassa). Ensimmäinen ionisoitumisenergia tarkoittaa uloimman elektronin irrottamiseen kuluvaa energiaa, toinen ionisoitumisenergia seuraavan elektronin irrottamiseen kuluvaa energiaa jne. Ensimmäinen elektroni irtoaa helpoiten. Seuraavien elektronien poistamiseen tarvittavat energiat ovat aina suurempia kuin edelliset ionisaatioenergiat

Kuvaajassa ensimmäinen ionisoitumisenergia pienenee järjestysluvun ja atomin koon kasvaessa. Atomiytimen varaus muuttuu järjestysluvun mukaisesti, ja atomin elektroniverho kasvaa ytimen varauksen myötä. Ydinvarauksen vaikutus elektroniverhon uloimpiin osiin riippuu siitä, kuinka suuri varaus on ja mikä on uloin miehitetty elektronikuori. Kuviossa näkyy jaksollinen vaihtelu: jakson alussa ensimmäinen ionisoitumisenergia on pienempi kuin sen lopussa, sillä ydinvaraus on pienempi jakson alussa kuin lopussa, huiput osuvat pääasiassa jalokaasujen kohdalle. Kuvaajan alkupuolen minimikohdat taas osuvat alkalimetallien kohdalle, esim. 18 Ar ,argon, (huippu), 19 K, kalium (minimi). Ionisoitumisenergia pienenee myös ryhmissä alaspäin, sillä elektronien etäisyys ytimestä kasvaa tässä suunnassa. Kemiallisesti inerteillä aineilla on suuri ionisoitumisenergia, esim. jalokaasut ja 79 Au.
Ionisoitumisenergiat ovat yllättävän alhaisia välillä Z = 57 – 71 eli lantanoidien kohdalla, mikä kertoo niiden atomien pienestä koosta ("tiiviydestä").
a) Alkeeni ja aromaattinen
hiilivety
Alkeenissa on vähintään yksi kaksoissidos,
jonka elektronipilvi mahdollistaa additio- eli liittymisreaktiot.
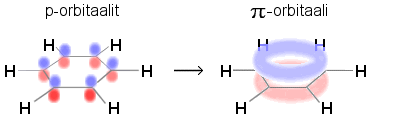
Aromaattisessa hiilivedyssä on rengasrakenteita, joissa
näyttäisi rakenteellisesti olevan kaksoissidoksia, mutta
p-sidoselektronit ovat niissä delokalisoituneet ja muodostavat
yhtenäisen energialtaan edullisen π-elektronipilven, jonka olisi
rikkouduttava additioreaktiossa, joten additiota ei helposti tapahdu vaan
renkaan vetyatomit (tai muut atomit ja ryhmät) osallistuvat helposti
substituutio- eli korvautumisreaktioihin.
Bentseenin
elektronirakenne
b) Aromaattinen alkoholi ja fenoli
Aromaattisessa
alkoholissa hydroksyyliryhmä ei ole kiinni suoraan aromaattisessa
renkaassa, fenolissa puolestaan hydroksyyliryhmä on sitoutunut renkaan
hiiliatomiin.
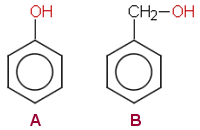 |
A
Fenoli B Bentsyylialkoholi aromaatiinen alkoholi |
Fenolit ovat heikkoja happoja mutta aromaattiset alkoholit eivät ole selvästi happamia ja ne (esim. bentsyylialkoholi) reagoivat kuten muutkin alkoholit: muodostavat eettereitä, esteröityvät, primaariset ja sekundaariset hapettuvat jne. (Myös fenolit muodostavat estereitä.)
c) Tärkkelys ja selluloosa
ovat molemmat
glukoosista muodostuneita polysakkarideja. Niiden välinen perusrakenne-ero
on glukoosiyksiköiden sitoutumistavassa.
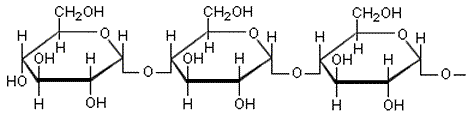
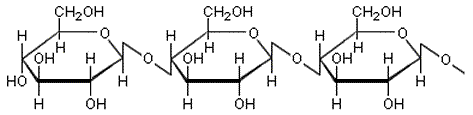
Tärkkelyksessä voi olla tuhansista miljooniin glukoosiyksikköihinketjuuntuneina. Ketju on spiraalimaisesti kiertynyt, ja siinä saattaa esiintyä myös haaroja. Vesimolekyylit pystyvät tunkeutumaan glukoosiketjun väleihin, katkomaan vetysidoksia ja muodostamaan uusia sidoksia OH-ryhmien kanssa. Seurauksena on tärkkelyksen paisuminen ja vesiseoksen hyytelöityminen.
Selluloosassa on tuhansia glukoosiyksiköitä, jotka ovat kiertyneet toisiinsa nähden 180°. Ketjut muodostavat vetysidoksia toisiinsa ja ryhmittyvät siten lujiksi, melko jäykiksi säikeiksi, jotka eivät liukene veteen.
Kuvia ja / tai reaktioita on hyvä esittää. Selluloosan ja tärkkelyksen rakennetta ei tietenkään edellytetä piirrettäviksi. Ne vain sattuivat löytymään tähän vanhoista valintakoetehtävistä, joten selvyyden vuoksi liitin ne mukaan. Aromaattisuuskin riittänee sanoin kuvattuna. Reaktioita voisi kyllä kirjoittaa. Esimerkit eroista voivat olla monenlaisia. Tässä on vain muutamia
MAOL: c-kohta, esim. tärkkelys sopii ihmiselle ravinnoksi, selluloosa ei (erot voi selittää reaktioyhtälöin tai sanallisesti a- ja b-kohdassakin). Rakennekaavojen puuttumisesta –1 piste. (Ei varmaankaan koske c-kohtaa. MK)
a) A vetykaasua H2(g), B rikkivetykaasua (divetysulfidia) H2S(g), C happikaasua O2(g)
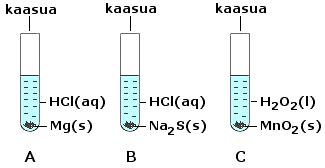
b) Reaktioyhtälöt:
| A Mg(s) + 2 HCl(aq) → MgCl2 (aq) + H2(g) B Na2S(s) + 2 HCl(aq) → 2 NaCl (aq) + H2S(g) C 2 H2O2(l) |
| MgO2(s) toimii reaktiossa
C katalyyttinä. * Olomuotomerkintä voi olla myös (g). |
MAOL-pisteet kohdittain: a-kohdasta 3 × 2/3 p, b-kohdasta 3 × 4/3 pistettä. MnO2:n puuttumiseta ei ollut mainintaa pisteitysohjeessa, joten arvaukseksi jää – 1 piste tai – 2/3-pistettä.
a) Lasketaan sekoituksessa syntyvät
c(AgNO3) ja
c(NaCl)3:
c(AgNO3) =
n(AgNO3) : V = 15 ml · 0,0010
mol/l : 30 ml = 0,00050 mol/l
Vastaavasti c(NaCl) = 0,00050
mol/l
c(AgNO3) · c(NaCl) = (0,00050
mol/l )2 = 2,5 · 10 –7
(mol/l)2
c(AgNO3) ·
c(NaCl) > KL (AgCl) =1,8 · 10
–10 (mol/l)2.
Astiaan saostuu siis
hopeakloridia.
b) Tasapainon asetuttua astiassa on kylläinen AgCl-liuos,
jossa c(Ag+) = c(Cl–) .
Koska
ioneja on 1 : 1 alkuaan ja saostuminenkin tapahtuu samassa suhteessa.
Liukoisuustulon perusteella saadaan
KL (AgCl) =
c(Ag+) ·
c(Cl–)
c(Ag+) =
KL 0,5(AgCl)
( 1,8 · 10
–10)0,5 (mol/l)2 · 0,5= 1,3
· 10 –5 mol/l.
c(Ag+) =
1,3 · 10 –5 mol/l
a) Titrauskäyrä
Ekvivalenttikohta on
hyppäyksen keskellä, pH-arvon ollessa lähes 9 (heikon hapon
titraus vahvalla emäksellä). Kulutusarvio 8,2 ml (voisi olla
8,3:kin).
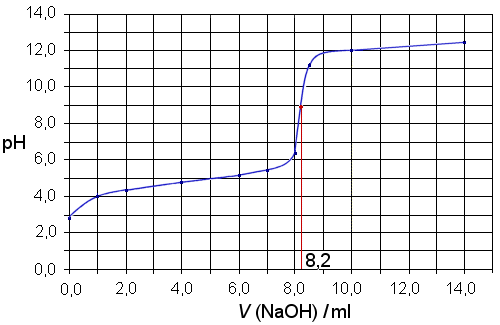
V(happo) = 25,0 ml, c(NaOH) = 0,194 M
c(happo) =
8,2 ml · 0,194 M : 25,0 ml = 0,063632 M
m
(CH3COOH) / l = 60,05 g/mol · 0,063632 M = 3,8211
g/l
Etikkahappopitoisuus on siis 3,8 g/l.
Ekvivalenttikohdan arvo vaikuttaa herkästi
lopputulokseen.
Rajamäen väkiviinaetikan etikkahappopitoisuudeksi
ilmoitetaan 10 %.
Koska tällaisen
väkiviinaetikan tiheys on vain n. 1,005 g/ml. 10 %:ssa liuoksessa
etikkahappoa on 100 g/l. Tehtävässä on kyseessä on siis
huomattava laimennos.
b) Laimennuksessa saadun titrausliuoksen tarkalla tilavuudella ei ole väliä, koska laimennos tapahtuu tietenkin vedellä eikä muuta etikkahapon ainemäärää astiassa. Titraus perustuu reaktioon, jossa ainemäärät ovat ratkaisevia, eivät konsentraatiot sinänsä. Vain etikkahappo kuluttaa NaOH-liuosta.
c) Indikaattorin valinnassa kiinnitetään huomiota värinmuutoskohdan sijaintiin. Sen tulee osua melko tarkasti sille pH-alueella, jossa ekvivalenttikohta on. Värinmuutoksen selkeys on myös tärkeää. Koska tässä titrataan heikkoa happoa vahvalla emäksellä, ekvivalenttikohta osuu emäksiselle puolelle. Hyvä indikaattori olisi fenoliftaleiini, jonka värinmuutosalue on pH 8,3 – 10,0. Värinmuutos värittömästä punaiseksi on myös selkeä.
MAOL: hyväksyttävä ekvivalenttikohta välillä 8,2 – 8,4, pieni poikkeama näistä –1/3 pistettä. Kokonaan väärin tulkittu ekvivalenttikohta –2 pistettä.
Yhdiste A C5H10O sekä hapettuu että pelkistyy ja sisältää yhden karbonyyliryhmän, joten sen täytyy olla aldehydi. Koska A on optisesti aktiivinen, sen hiiliketju on haaroittunut. Pelkistymisessä (2) syntyvä yhdiste C C5H12O on alkoholi. Hapettumisessa saadaan yhdiste C C5H10O2, joka on karboksyylihappo. B:n ja C:n välisessä reaktiossa syntyy esteri D.
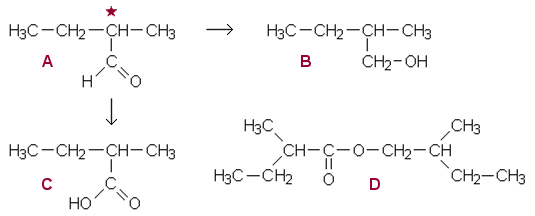
Asymmetrinen hiiliatomi on merkitty tähdellä yhdisteeseen A.
MAOL: Jos A:n optista aktiivisuutta ei ollut huomioitu, tehtävästä sai korkeintaan 3 pistettä.
![]() Kolme tehtävää 10, 3 c, 5
YLE,
Klaffi, Professori Saarisen vastaus, kolme tehtävää 10, 3 c,
5 (5:26 min)
Kolme tehtävää 10, 3 c, 5
YLE,
Klaffi, Professori Saarisen vastaus, kolme tehtävää 10, 3 c,
5 (5:26 min)
a) Rakennekaavat (tilarajoitteen takia lyhennetyt
rakennekaavat ja reaktio kahdella rivillä)
A glyseroli, B
öljyhappo, C rasvaesteri
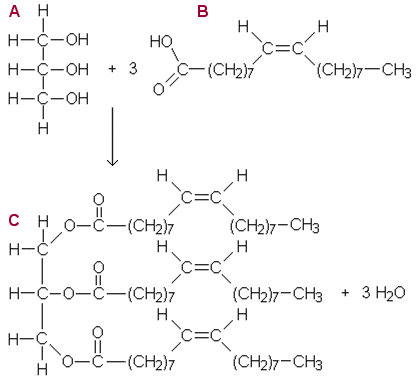
b) Reaktiossa vapautuu myös glyserolia, jonka rakennekaava yllä, alla saippua eli natriumpalmitaatti.
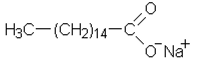 |
eli H3C—(CH2)14—COO– Na+ |
| Natriumpalmitaatti | |
c) Linolihapon erään isomeerin (D) ja siitä saadun tyydyttyneen rasvahapon (E) rakennekaava:
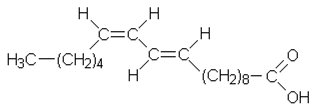 |
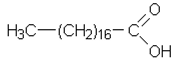 |
| D | E |
Huom. Yhdisteiden nimiä ei tarvinnut mainita. Tässä ne on otettu selvyyden vuoksi mukaan osalle yhdisteitä.
d) Titrauksen pohjana oleva reaktio:
Lasketaan reagoimatta jääneen jodin määrä.
Reaktioyhtälön mukaan
n(I2) = 0,5
· n(Na2S2O3) = 0,5
· V(Na2S2O3) ·
c(Na2S2O3) = 0,5 ·
20,6 ml · 0,142 M
m(I2) =
M(I2) · n(I2) = 253,81 g/mol
· 0,5 · 20,6 · 0,142 ·
10–3mol = 0,371 g
Reagoineen jodin määrä on
siten 43,8 g – 0,371 g.
Lasketaan jodin määrä 100 g
rasvaa kohti: 100 g · (43,8 g – 0,371 g) : 35,3 g =
123 g
Jodiluku on 123 g /100 g tai 123.
Huom. Maissisöljyn jodiluvun on oltava välillä 103-128 g/100 g. EU-komission tiedonanto 32000Y1031(01)
MAOL: jos molekyylien geometrinen muoto on puutteellisesti esitetty, – 1 piste tai –2 pistettä.
MK: b-kohdassa ei tarvinnut mainita glyserolia.
a) Polttokenno on laite, joka muuntaa polttoaineen kemiallisen energian suoraan sähköksi sähkökemiallisten hapettumis-pelkistymisreaktioiden avulla. Polttokenno-nimi viittaa palamiseen, mutta varsinaista palamisreaktiota kennossa ei siis tapahdu. Polttokennossa on kaksi elektrodia, joilla sähkökemialliset reaktiot tapahtuvat. Kennon olennainen osa on myös elektrolyytti, jossa ionit pääsevät liikkumaan elektrodilta toiselle. Sähköenergian lisäksi prosessissa vapautuu lämpöä. Reaktiotuotteena on puhdasta vettä.
Polttokenno on toiminnaltaan ympäristöystävällinen, koska sen tuottaa päästönä puhdasta vettä, mutta polttokennotekniikan monipuolinen hyödyntäminen voi myös epäsuorasti vähentää ympäristöhaittoja. Esim. autoissa polttokennot pienentävät fossiilisten polttoaineiden kulutusta ja niiden palaessa syntyviä päästöjä, vaikka polttokenno ei olisikaan ainoa auton tehonlähde. Tämä johtuu siitä, että polttokennolla voidaan päästä parempaan hyötysuhteeseen kuin polttomoottorilla. Polttokennojen hyödyntäminen pienlaitteissa (mm. kannettavassa elektroniikassa) keventää loppuun käytetyistä akuista aiheutuvaa ympäristökuormitusta. Polttokennoilla tuotettua sähköä voidaan (tulevaisuudessa) käyttää kotitalouksissa täydentävänä energianlähteenä ja siten rajoittaa ympäristöhaitoiltaan hankalampien energianlähteiden käyttöä.
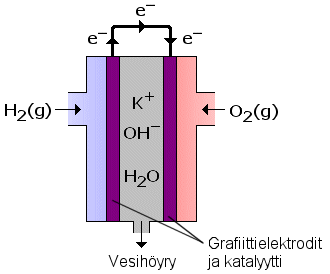
b) Paineistettua vetykaasua johdetaan anodipuolelta kennoon katalyytin läpi. H2-molekyylit pilkkoutuvat katalyyttisesti kukin kahdeksi H+-ioniksi, jolloin vapautuu kaksi elektronia (e–). Elektronit kulkevat anodilta ulkoista johdinta pitkin katodille. Virtaa voidaan hyödyntää tässä vaiheessa.
Katodille johdetaan happikaasua, joka hajoaa katalyyttisesti happiatomeiksi. Happiatomeihin jää negatiivinen varaus, joka vetää puoleensa vetyioneja. Ionit yhtyvät vedeksi ja ottavat tarvittavat elektronit katodille tulevasta sähkövirrasta.
Alkalipolttokennossa (kuva) elektrolyyttinä on kaliumhydroksidiliuos ( K+ ja OH–). Emäksinen elektrolyytti ei siedä hiilidioksidia, joten hapen on oltava puhdasta.
Reagensseja syötetään jatkuvasti. Elektrodit ovat käytännöllisesti katsoen kulumattomia.
| Anodireaktio hapettuminen |
2 H2 → 4 H+ + 4e– | E = +0,83 V |
| Katodireaktio pelkistyminen |
O2 + 4 H+ + 4e–
→ 2 H2O |
E = +0,40 V |
| Nettoreaktio | 2 H2 + O2 → 2 H2O | Kok. 1,23 V * |
| * teoreettinen
(käytännössä n. 1 V), |
Arvot taulukkokirjasta |
Tämä on vain eräs lähestymistapa. Vastaus on mahdollista rakentaa muutenkin.
Lisäyksiä ja vaihtoehtoja
Lisäys 3.4.06 MK
Muutamia linkkejä, joista voi aloittaa