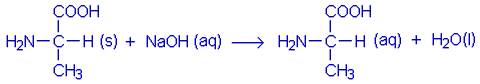KEMIAN SIVUT
Kemian ylioppilastehtävien ratkaisut, syksy 2006
1 | 2 | 3 |
4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
kysymykset (erilliseen
selainikkunaan)
| Yhdiste |
C2H2 |
C3H8 |
CH3OH |
HCOOH |
CH3OCH3 |
 |
| Hiilivety |
kyllä |
kyllä |
ei |
ei |
ei |
kyllä |
Tyydyttymätön
yhdiste |
kyllä |
ei |
ei |
ei |
ei |
kyllä* |
Poolinen
molekyyli |
ei |
ei |
kyllä |
kyllä |
ei |
ei |
Vetysidoksia
molekyylien
välillä |
ei |
ei |
kyllä |
kyllä |
ei |
ei |
Hapan
vesiliuos |
ei |
ei |
ei |
kyllä |
ei |
ei |
* Yhdiste on bentseeni, joka on aromaattinen yhdiste. Aromaattiset
yhdisteet luokitellaan tyydyttymättömiksi molekyylin vetyatomien ja
hiiliatomien määrien suhteiden perusteella. Reaktioiden perusteella
aromaattiset yhdisteet voisivat kuulua tyydyttyneisiin yhdisteisiin.
a) Reaktioyhtälö:
2 NH3(g) + CO2(g)
→ (NH2)2CO(s) +
H2O (l)
b) Lasketaan ammoniakin ja hiilidioksidin
ainemäärä
| m (g) |
NH3 |
CO2 |
| 637 |
1140 |
| M (g/mol) |
17,03 |
44,01 |
| n = m : M (mol) |
37,405 |
25,903 |
M(urea)
= 60,06 g/mol
m = n M
Ammoniakin kerroin reaktioyhtälössä on 2, joten
ammoniakkia kuluu
37,405 mol : 2 = 18,7025 mol
Ammoniakin
määrä on siten rajoittava tekijä.
Ureaa saadaan korkeintaan
m(urea) = 18,7025 mol
· 60,06 g/mol = 1123 g , tarkkuus huomioiden
1120 g.
3. Palamisreaktioiden
yhtälöt:
C2H6(g)
+ 3,5 O2(g) → 2 CO2(g) +
3 H2O(g)
CnH2n(g) + 1,5 n O2(g)
→ n CO2(g) + n
H2O/g)
Lasketaan kuinka paljon (tilavuudet) happea etaani ja alkeeni
kuluttavat. Voidaan käyttää tilavuuksia, koska reaktiot
tapahtuvat kaasufaasissa (ja suljetussa astiassa).
| C2H6: |
3,5 · 50 ml = 175 ml |
| CnH2n: |
1,5 n · 70 ml = 105 n ml |
Hapen määristä saadaan yhtälö:
(105 n + 175
+ 30 ) ml = 520 ml eli 105 n ml = 315 ml, josta n:n arvoksi tulee 3. Alkeenin
molekyylikaava on siis C3H6.
a) Reaktioyhtälö:
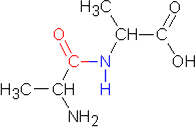
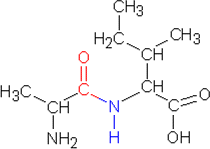
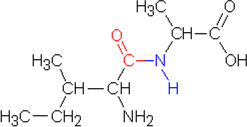
b) Reaktiossa syntyy neljää dipeptidiä:
alaniini - alaniini, alaniini - isoleusiini, isoleusiini - alaniini ja
isoleusiini - isoleusiini
 |
 |
| alaniini-alaniini |
alaniini-isoleusiini |
 |
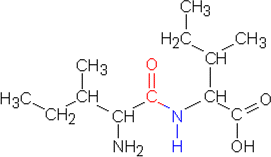 |
| isoleusiini-alaniini |
isoleusiini-isoleusiini |
Kaavat voidaan piirtää usealla tyylillä.
Tässä hiiliketjut on piirretty polveileviksi
ChemSketchin tyyliin.
a) Liuoksen pH
Lasketaan
[H3O+], joka on sama kuin c (HCl).
[H3O+] =1,0 · 10–3 mol
: 0,50 l = 2,0 · 10–3 mol/l
pH = –
log 2,0 · 10–3 = 2,7
b) Kun pH = 3,00, [H3O+] =
10–3 mol/l
Merkitään laimennetun liuoksen
tilavuutta V:llä. Ainemäärien (n = cV)
perusteella saadaan yhtälö:
V·
10–3 mol/l = 1,0 · 10–3 mol,
josta saadaan V = 1 litra.
c) Merkitään lisättävää
NaOH-liuoksen määrää x:llä.
Liuoksen
lopputilavuus on x + 0,50 litraa.
Koska liuoksen pH:n tulee olla
12,00, sen pOH on silloin 14,00 – 12,00 = 2,00, josta saadaan
[OH–] = 10–2.
| Ainemäärä (mol) |
Lisätty OH– |
Neutralointiin
kului |
Liuokseen jää |
| 0,10 · x |
1,0 · 10–3 |
10–2(x + 0,50)
|
Laaditaan yhtälö
OH–-ionien ainemäärien perusteella
0,10 x =
0,001 + 0,01(x + 0,50), josta ratkaisuna
x = 0,006 :
0,09 = 0,06666
NaOH-liuosta on lisättävä 0,067 l = 67
ml
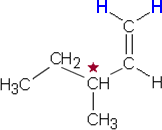
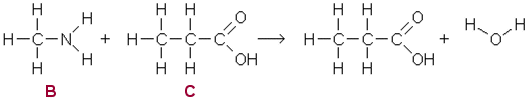
Yhdisteet A
CH3CH2CH(CH3)CHCH2, B
CH3NH2, C CH3CH2COOH
a) Yhdisteen A rakennekaava, johon asymmetrinen
(kiraalinen) hiiliatomi on merkitty tähdellä.:
b) Valmistettaessa yhdistettä A synteettisesti
saadaan molempia optisia isomeerejä. Tuotteeksi syntyy raseeminen seos,
joka ei ole optisesti aktiivinen.
c) Yhdisteestä A ei ole olemassa
cis-trans-isomeerejä, sillä kaksoissidoksen toiseen
hiiliatomiin on liittynyt kaksi vetyatomia. Kuvassa atomit on merkitty
sinisellä.
d) Reaktio
a) Metallit johtavat sähköä, koska
metallisidoksessa sidoselektronit pääsevät liikkumaan atomien
välisessä tilassa. Metalliatomeissa on uloimmalla kuorella vajaa
elektronimiehitys (vain 1 — 4 elektronia).
Metalliatomien sitoutuessa toisiinsa uloimmat kuoret
eivät silloinkaan täyty tai saavuta oktettia. Atomien uloimmat
elektronit muodostavat "elektronimeren", jonka negatiivinen varaus sitoo
metalliatomit hilaan mutta jossa elektronit eivät ole lokalisoituneet vaan
pystyvät siirtymään vajaamiehitettyihin orbitaaleihin.
b) Jalokaasuilla on alhainen kiehumispiste, koska ne
koostuvat lähes irrallisista atomeista. Niiden atomien väliset
sidosvuorovaikutukset ovat heikkoja dispersiovoimia (van der Waalsin sidoksia).
Jalokaasuilla on uloimmalla elektronikuorella oktetti lukuun ottamatta
heliumia, jolla on täydellä uloimmalla kuorellaan kaksi elektronia.
Elektronirakenteensa takia jalokaasut eivät muodosta alkuaineina
esiintyessään molekyylejä. Niinpä dispersiovoimat
jäävät atomien välisiiksi ja siitä syystä
heikoiksi. Dispersiovoimien suuruushan riippuu sitoutuvien hiukkasten koosta ja
elektronien määrästä.
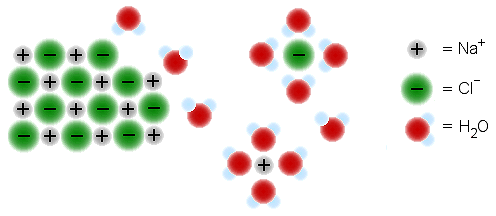
c) Suolat liukenevat veteen, koska niillä on ionihila.
Pooliset vesimolekyylit pääsevät liittymään hilan
ioneihin, siten purkamaan sen ja hydratoimaan irronneet ionit, jotta ne
pysyvät vesiliuoksessa. Kuvassa esimerkkinä NaCl-hilan purkautuminen
ja ionien hydratoituminen.
a) Pulloa avattaessa olueen liuenneet kaasut
(pääasiassa hiilidioksidi) pääsevät poistumaan ja
poistuessaan aiheuttavat kuohunnan. (Olut sisältää sokereita,
pieniä määriä valkuaisaineita ym. yhdisteitä, jotka
vaikuttavat kuohun muodostukseen.) Kaasut poistuvat, koska pullon avaaminen
rikkoo sen sisällä (suljetussa systeemissä) vallitsevan
liukoisuustasapainon. Le Châtelier'n periaatteen mukaisesti pyrkii
muodostuman uusi tasapainotila, mutta koska uusi systeemi on avoin, kaasun
virtaus jatkuu.
b) Viini happanee helposti avoimessa pullossa, sillä
siinä oleva etanoli hapettuu ilman hapen (ja viinissä olevien
entsyymien) vaikutuksesta etikkahapoksi (tapahtuu
etikkahappokäymistä).
C
2H
5OH

CH
3COOH
c) Kananmunan valkuainen hyytyy keitettäessä, koska sen
sisältämien liuenneiden (kolloidisten) valkuaisaineiden tertiaari- ja
sekundaarirakenne purkautuu kuumennuksessa ja purkautuneet aminohappoketjut
liittyvät toisiinsa sikin sokin suuriksi kokkareiksi, ts. valkuaisaineet
koaguloituvat. Kuorineen keitetyssä kananmunassa valkuainen
jää yhtenäiseksi kiinteäksi kerrokseksi kuoren takia.
Keitettäessä rikkoutuneesta munasta valkuainen valuu keitinveteen ja
muodostaa selvemmin kokkareisen rakenteen.
Atomien kokoon vaikuttavat elektroniverho ja
ytimen varaus. Elektroniverhon osalta oleellisia tekijöitä
ovat elektronikuorten määrä ja miehitys.
Vety (H) on atomikooltaan pienin, koska sillä on vain yksi protoni
ytimessään ja yksi elektroni K-kuorella. H+-ioni on
H-atomia pienempi, koska elektroni on poistunut kokonaan.
Alkalimetallien ryhmässä (Li — Cs) atomien koko kasvaa
järjestysluvun, siis myös ytimen varauksen, kasvaessa, koska
elektronikuorten määrä kasvaa. Uloimmalla kuorella on yksi
lelektroni, joka irtoaa positiivisen alkalimetalli-ionin syntyessä. Ionin
koko on näin ollen pienempi kuin vastaavan atomin koko. Vastaava
kokomuutos esiintyy selvästi myös ryhmässä
maa-alkalimetalleilla (Be — Ba). Booriryhmässä ja sitä
seuraavissa ryhmissä atomien koon kasvu järjestysluvun kasvaessa ei
ole yhtä selvä, mikä johtuu lähinnä uloimman
elektronikuoren runsaammasta elektronimäärästä, johon
ytimen varaus ulottaa hyvin vaikutuksensa.
Jaksossa alkalimetalleista halogeeneihin atomien koko pienenee
järjestysluvun kasvaessa — tosin monet jakson loppupään
atomeista ovat liki samankokoisia. Elektronikuorten lukumäärä ei
kasva samassa jaksossa vasemmalta oikealla siirryttäessä vaikka
elektronin määrä lisääntyykin. Jotkin raskaat
alkuaineet poikkeavat hieman säännöstä (Te ja Po) runsaan
elektronimääränsä ja ytimen varauksen vaikutusta hajottavan
neutronimäärän takia.
Elektronin menettäminen pienentää kokoa ja elektronien
vastaanottaminen taas suurentaa: metalliatomien muodostamat positiiviset ionit
ovat varauksetonta atomia pienempiä, kun taas epämetallien
negatiiviset ionit (esim. halogeenien ionit) ovat alkuperäistä atomia
suurempia. Metalli-ionien koko pienenee jaksossa siten, että
alkalimetallien ionit ovat suurimpia (Na+-ionista alkaen).
Ilmiö osoittaa, että elektroni — vaikka onkin massaltaan pieni
hiukkanen — vaatii tilaa varauksensa vuoksi ja hylkiessään
toisia elektroneja. Lisäksi ilmiö osoittaa, että
sähköisen vuorovaikutuksen ollessa riittävän voimakas
(protoneja runsaasti) ytimen ja elektroniverhon välillä, elektronit
pakkautuvat lähemmäs toisiaan ja ydintä.
Valkoinen jauhe on joko kaliumkloridia KCl, kaliumfluoridia
KF tai kaliumkarbonaattia K2CO3. Lakmuspaperin
värinmuutos viittaa emäksiseen aineeseen , mutta koska HCl(aq) ei
aiheuta näkyvää reaktiota, kyseessä ei voi olla
K2CO3. KCl on vahvan hapon (HCl) ja vahvan emäksen
(KOH) suola, joten sen vesiliuoksessa ei tapahdu hydrolyysiä, joka
tuottaisi lakmuksella nähtävän emäksisen reaktion. KF on
vahvan emäksen (KOH) ja suhteellisen heikon hapon, vetyfluoridin
H2F2 (tai HF) suola. Vetyfluoridin happovakion arvo on
6,8 · 10–4mol/l. KF:n liuoksessa tapahtuu siten
hydrolyysi, joka tuottaa liuokseen OH–-ioneja. Nämä
värjäävät lakmuspaperin siniseksi. Valkoinen jauhe on
siis kaliumfluoridia KF.
a) Hiilimonoksidi (CO) on hengitettynä
myrkyllistä, koska se estää hapen sitoutumisen hemoglobiinin.
Hiilivedyt saattavat aiheuttaa hengitystieärsytystä ja jopa altistaa
syövälle. Ko. yhdisteet ja erityisesti typpimonoksidi
edistävät alailmakehän otsonin muodostusta. Otsoni puolestaan on
vahvasti hapettavaa, korroosiota aiheuttavaa ja hengitettynä
myrkyllistä.
Alailmakehän kohonneet otsonipitoisuudet ovatkin aurinkoisen
vuodenajan paha ilmanlaatuongelma joka puolella Eurooppaa. Alailmakehän
otsonipitoisuuden kasvun merkittävin aiheuttaja on liikenne. Suomen
pahimmat otsonipiikit esiintyvät kesäisin korkeapaineen vallitessa.
Tällöin myös muualta Euroopasta kulkeutuu Suomeen otsonia ja
muita ilmansaasteita sisältävää ilmaa. Lisäksi omien
hiilivety- ja typenoksidipäästöjemme aiheuttama otsoninmuodostus
on helteellä runsasta. Otsonin määrä riippuu vuorokauden
ajasta: otsonin määrä on suurimmillaan
iltapäivällä ja alkuillasta. Yöllä pitoisuudet
alenevat. Taajamissa otsoni reagoi herkästi muiden ilmansaasteiden kanssa
ja otsonipitoisuudet laskevat näin ollen usein alemmas kuin
lähimaaseudulla. Maaseudun puhtaammassa ilmassa otsonin kehittyminen on
vallitseva prosessi. Korkeimmat otsonipitoisuudet voivatkin hieman
yllättäen esiintyä alueilla, joilla päästöjä
on hyvin vähän tai ei juuri lainkaan.
Vaikka katalysaattorit muuntavat hiilimonoksidia, hiilivetyjä ja
typpimonoksidia vähemmän haitallisiksi yhdisteiksi, ilmanlaatu kaipaa
silti kohentamista, sillä katalysaattorit eivät pysty kokonaan
estämään mainittujen haitallisten aineiden syntyä
liikenteessä. Ko. aineiden lähteitä on toki muuallakin, mutta
liikenteen päästöt ovat edelleen suurin ongelma.
b) Katalysaattorin toiminta perustuu katalyysiin eli
kemiallisten reaktioiden nopeuttamiseen. Kolmitoimikatalysaattoreissa
hiilimonoksidi eli häkä (CO) hapettuu hiilidioksidiksi
(CO2), palamattomat hiilivedyt hapettuvat hiilidioksidiksi ja
vedeksi. Typpimonoksidit (NO puolestaan pelkistyy typeksi (N2).
| Yhdiste |
Reaktio |
Tuote |
| CO |
hapetus |
CO2 |
| Hiilivedyt |
hapetus |
CO2 + H2O |
| NO |
pelkistys |
N2 |
Katalysaattori voi hapettaa myös rikkidioksidin (SO2)
rikkitrioksidiksi (SO3), joka muodostaa veden kanssa rikkihappoa
(H2SO4).
Katalysaattorissa on keraaminen tai metallinen kennosto, joka on
pinnoitettu katalyyteillä. Katalyytteinä käytetään
jalometalleja ja niiden seoksia, platinaa (Pt) ja rodiumia (Rh). Jalometalleja
tarvitaan vain pari grammaa, vaikka kennoston pinta-ala on suuri. Suuri
pinta-ala on tärkeä, jotta kaasumolekyylit kulkeutuisivat
mahdollisimman tarkkaan katalyyttipinnalle ja reagoisivat. Reaktiot vaativat
korkean lämpötilan (n. 300 °C). Katalysaattori ei siis pysty
toiminaan heti auton käynnistämisen jälkeen vaan vasta
pakokaasujen lämmitettyä katalysaattoria rittävästi.
Katalysaattoriautoissa on käytettävä lyijytöntä
polttoainetta, koska lyijy tuhoaa katalysaattorin.
Tässäpä pääpiirteitä.
Voisi vastata toisinkin.
Titrausreaktio:
I2(s) + 2
Na2S2O3(aq) →
Na2S4O5(aq) + 2 NaI(aq)
Reaktioastian
numero |
HI(g):n
alkuperäinen
määrä grammoina |
Astian
avaamisaika
reaktion alusta lukien
tunteina |
Titrauksessa
kuluneen
tiosulfaatin tilavuus
millilitroina |
| 1 |
0,300 |
2 |
20,96 |
| 2 |
0,320 |
4 |
27,90 |
| 3 |
0,315 |
12 |
32,31 |
| 4 |
0,406 |
20 |
41,50 |
| 5 |
0,280 |
40 |
28,68 |
| Merkintöjä |
ma(HI) =
ma |
|
V |
Titraamalla saadaan selville tasapainoseoksen koostumus seuraavasti:
Tasapainoseoksen koostumus
2 HI(g)
 H 2(g) + I 2(g) |
Jodin määrä
mmol:
c(Na2S2O3) = c = 0,0150
M
n(I2) = ½ · c ·
V |
Vedyn määrä
mmol:
n(H2) = n(I2) |
HI:n alkumäärä mmol:
na(HI)
= 1000 · ma :
M(HI)
M(HI) = 127,91 g/mol
|
Vetyjodidin määrä
mmol:
na — c · V |
Reaktioastian
numero |
na(HI) |
n(I2) |
n(H2) |
n(HI) |
K |
| 1 |
2,34540 |
0,15720 |
0,15720 |
2,03100 |
0,00599 |
| 2 |
2,50176 |
0,20925 |
0,20925 |
2,08326 |
0,01009 |
| 3 |
2,46267 |
0,24233 |
0,24233 |
1,97802 |
0,01501 |
| 4 |
3,17411 |
0,31125 |
0,31125 |
2,55161 |
0,01488 |
| 5 |
2,18904 |
0,21510 |
0,21510 |
1,75884 |
0,01496 |
K = [H2] · [I2] :
[HI]2
Laskettaessa konsentraatioiden lausekkeessa
esiintyvä tilavuus supistuu pois. Moolien asemesta laskuissa
käytettiin millimooleja, koska titraustulosta oli näin helppo
käsitellä (eikä virhettä aiheudu K:n lausekkeen
muodon takia). HI:n alkuperäinen määrä laskettiin
siitä syystä millimooleiksi.
Reaktioastioissa 1 ja 2 tasapaino ei ehkä ole ehtinyt asettua,
koska ajat olivat 2 h ja 4 h, joten jätetään niistä saatu
tasapainovakion arvo pois keskiarvoa laskettaessa.
K = (0,01501 +
0,01488 + 0,01496 ) : 3 = 0,01495, K = 0,0150
Tuloksen luotettavuuteen vaikuttaa, että
– reaktion
tasapaino on varmasti ehtinyt asettua
– jodia estetään
haihtumasta titraukseen ryhdyttäessä (faasinmuutos g —>
s!)
– mittaukset ovat täsmällisiä (titrauksen
onnistuminen, HI:n alkuperäisen määrän tarkkuus)
–
lämpötila pysyy vakiona reaktion kestäessä
– astiat
ovat puhtaita (ettei pääse tapahtumaan sivureaktioita) ja niitä
käsitellään siististi.