1 | 2 | 3 | 4 | 5 | 6 | 7 | +8 | kysymykset (erilliseen selainikkunaan)
a) Liuos on kylläinen, kun siihen on liuennut ainetta suurin mahdollinen määrä. Määrän suuruus riippuu liuottimesta, liukenevasta aineesta ja lämpötilasta (kaasujen liukeneminen myös paineesta). Kiinteän aineen kylläisessä liuoksessa on aina mukana kaksi faasia (olomuotoaluetta), nestefaasi ja kiinteä faasi. Faasien välillä vallitsee dynaaminen tasapainotila: kiinteästä faasista siirtyy ainetta liuokseen ja liuoksesta saostuu saman verran ainetta kiinteään faasiin. Liuoksen konsentraatio ei siis muutu. Myös nesteet ja kaasut voivat muodostaa kylläisiä liuoksia.
b) Elektrolyyttiliuos on liuos (tavallisesti vesiliuos), jossa vapaasti liikkuvat ionit voivat toimia sähkövirran kuljettajina. (Elektrolyyttiliuos on siis sähkönjohde.) Ioneja syntyy suolojen liuetessa veteen sekä happojen ja emästen protolyysireaktioissa. Puhdas vesikin ionisoituu, mutta sen ionien määrä on niin vähäinen [H3O+] = [OH–] = 10–7mol/l, ettei puhdas vesi voi toimia elektrolyyttinä. Tyypillisiä elektrolyyttiliuoksia ovat esimerkiksi NaCl:n, NaOH:n, HCl:n ja CH3COOH :n vesiliuokset. Elektrolyyttiliuoksen sähkönjohtokyky riippuu elektrolyytin konsentraatiosta (eli ionien määrästä liuoksessa, ionien määrä taas riippuu elektrolyytin liukoisuudesta tai hapon/emäksen vahvuudesta).
c) Liuoksen happamuus johtuu liuoksen sisältämistä oksoniumioneista H3O+. Liuos on hapan, jos siinä on enemmän oksoniumioneja kuin hydroksidi-ioneja. Kuta suurempi liuoksen oksoniumionikonsentraatio [H3O+] on, sitä happamampi liuos on. Liuoksen happamuuden mittana käytetään pH-asteikkoa, jossa neutraali liuos saa pH-arvon 7 ja happamien liuosten pH arvoja alle 7. Asteikko perustuu puhtaan veden [H3O+]:n arvoon, 10–7 mol/l. Liuoksen [H3O+] = 10 –pH eli pH = – log [H3O+].
d) Poolittomassa liuottimessa liuotinmolekyylien atomien väliset elektronegatiivisuuserot ovat usein hyvin pieniä. Tällaisia liuottimia ovat esimerkiksi hiilivedyt, kuten oktaani C8H18. Poolittomia liuottimia ovat myös sellaiset liuottimet, joiden molekyylirakenteessa suurehkot elektronegatiivisuuserot eivät vaikuta ulospäin molekyylin muodon takia. Tällainen liuotin on esimerkiksi hiilitetrakloridi CCl4, jonka molekyylissä neljä Cl-atomia ympäröi tetraedrin keskelle sijoittuneen C-atomin eikä varausero tunnu molekyylin ulkopuolelle. Myös dietyylieetteri CH3CH2–O–CH2CH3 on vastaavan tyyppinen pooliton liuotin, koska etyyliryhmät varjostavat keskelle sijoittuvaa elektronegatiivista O-atomia ja siitä lähteviä poolisia sidoksia. Liuotin on siis pooliton, kun sen molekyylit eivät ole dipoleja. (Kuva on vastauksessa eduksi.)
e) Kovaksi vedeksi sanotaan vettä, joka sisältää kalsiumioneja Ca2+ (mukana voi olla myös hieman magnesiumioneja Mg2+). Käytännössä veden kovuus näkyy usein siinä, että saippua ei "pese" hyvin vaan muodostaa hiutaleista saostumaa, ns. kalkkisaippuaa Ca2+-ionien kanssa. Kalkkisaippua on saippuan rasvahappojen ja kalsiumin niukkaliukoinen yhdiste. Juomavetenä kova vesi on miellyttävää ellei se sisällä kovin runsaasti Mg2+-ioneja, jotka antavat kitkerää makua. Vesilaitoksilla talousveteen tavallisesti lisätään "kovuutta" eli Ca2+-ioneja.
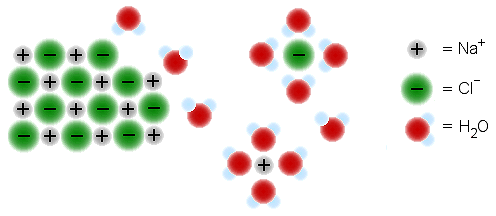
f) Kun ioniyhdiste liukenee, kidehilasta irtoavien ionien ympärille kertyy poolisia vesimolekyylejä. Negatiivisten ionien (anionien ) ympärille vesidipolit asettuvat positiiviset vetypäät ionia kohti. Positiivisten ionien (kationien) ympärille vesimolekyylit taas sijoittuvat negatiiviset happipäät ionia kohti. Näihin vesimolekyyleihin kiinnittyy vielä vaihtelevia määriä vesimolekyylejä dipolien suuntaamina. Ionien ympärille muodostuvaa vesimolekyylikerrosta sanotaan hydraattiverhoksi ja itse ilmiötä hydratoitumiseksi. Hydraattiverho pitää ionit liuoksessa estäen niitä muodostamasta kidehilaa. Joissakin tapauksessa osa hydraattiverhosta voi seurata ionien mukana kidehilaan kidevetenä (esim. CuSO4 · 5 H2O).

a) Reaktioyhtälö:
b) Lasketaan aluksi molempien lähtöaineiden ainemäärät.
n(H2S) = 4 · n(S8)
m(H2S) = 4 · 0,08575 mol ·
34,086 g/mol = 11,7 g
c) Koska reaktio tapahtuu suljetussa
astiassa, seoksesta ei poistu mitään. Kaikki rikki kuluu reaktiossa.
Astiaan jää vain kaasuja. Kemiallinen reaktio noudattaa aineen
häviämättömyyden lakia, joten kaasujen massa
on:
m = 22,0 g + 3,50 g = 25,50 g. V= 1,00 l
tiheys ρ =
m : V = 25,5 g/ l
Jos lasket kaasujen massan ainemääristä, älä unohda reagoimatonta metaania!
Kuvaajasta käy ilmi, että rikin (S), seleenin
(Se) ja telluurin (Te) vety-yhdisteiden kiehumispisteet ovat
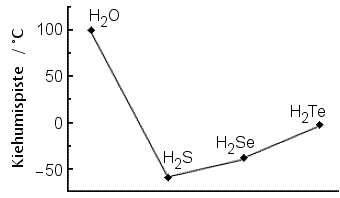
Kaikki mainitut vety-yhdisteet ovat molekyyliyhdisteitä, joiden molekyylien välillä on nestetilassa van der Waalsin sidoksia (dispersiovoimia). Vain H2O-molekyylit pystyvät muodostamaan lisäksi vetysidoksia. Tämä johtuu happiatomin pienestä koosta ja suuresta elektronegatiivisuudesta. Vetysidokset ovat huomattavasti voimakkaampia kuin van der Waalsin sidokset, mikä selittää veden poikkeavan kiehumispisteen.
Kolmella muulla vety-yhdisteellä kiehumispiste kohoaa järjestyksessä H2S < H2Se < H2Te eli samassa järjestyksessä kuin atomien S, Se ja Te koko ja elektronien määrä kasvaa. Tällöin myös molekyylien koko kasvaa.
Mitä enemmän elektroneja molekyylissä on, sitä voimakkaampia van der Waalsin sidoksia voi syntyä, mikä näkyy kiehumispisteissä. Myös molekyylin muoto vaikuttaa sidosten vahvuuteen, mutta tässä vertailtavien yhdisteiden molekyylit ovat samantyyppisiä, vain keskusatomin koko on erilainen, mikä tietysti vaikuttaa hieman sidoskulmiin (esim. H2O n.105 °, H2S n. 92° ).
Vastaukseksi riittävät pelkät rakennekaavat.
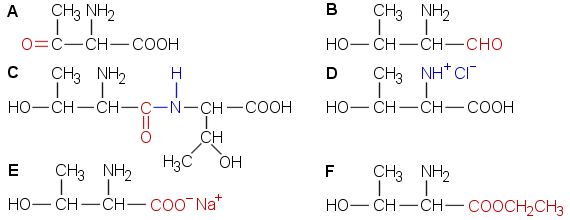
A Sekundaarinen alkoholi hapettuu ketoniksi. B Karboksyyliryhmä pelkistyy aldehydiksi tai alkoholiksi –CH2OH. C Aminohapot muodostavat peptidejä (pitemmätkin peptidiketjut ovat mahdollisia). D Aminoryhmä muodostaa HCl:n kanssa suolan. E Hapan karboksyyliryhmä neutraloituu, muodostuu natriumsuola. F Karboksyyliryhmä esteröityy etanolin kanssa.
Huomautus c-kohtaan (omaan selainikkunaansa)
Allotropia tarkoittaa, että alkuaine voi esiintyä samassa olomuodossa ominaisuuksiltaan ja rakenteeltaan erityyppisenä. Hapen allotrooppiset muodot ovat O2 eli happi ja O3 eli otsoni.
Otsonia syntyy hapesta UV-säteilyn vaikutuksesta ilmakehän yläkerroksissa, stratosfäärissä, jossa sitä myös hajoaa UV-säteilyn takia. Noin 90 % maapallon otsonista on stratosfäärissä, jossa otsoni muodostaa kerroksen (hyvin harvan ja ohuen). Otsonikerros suojaa maapalloa liialta UV-säteilyltä. Luonnollista otsonitasapainoa horjuttavat katalyyttisesti toimivat CFC-yhdisteet ja eräät muut yläilmakehään joutuneet yhdisteet (esim. CH3Br). Etenkin CFC-yhdisteet ovat ongelmallisia kemiallisen kestävyytensä takia: vaikutusaika on näin ollen pitkä ja leviäminen tehokasta. Otsonikerroksen oheneminen on osittain luonnollinen vuodenaikakiertoon liittyvä ilmiö, mutta nykyisellään selvästi ihmisen toiminnasta riippuva.
Otsonia syntyy myös alailmakehässä UV-säteilyn ja ilman saasteiden (lähinnä typen oksidien) vaikutuksesta. Alailmakehässä otsoni on haitallinen aine, joka on osallisena ns. fotokemiallisessa sumussa. Otsonia voi esiintyä ilman fotokemiallista sumuakin runsaan UV-säteilyn ja ilmakehässä kaukaakin kulkeutuneiden epäpuhtauksien synnyttämänä. Otsonikerroksen oheneminen vaikuttaa siis myös alailmakehän otsonipitoisuuteen.
Otsoni on voimakas hapetin, jonka haittavaikutukset eliöstölle ja materiaaleille johtuvat juuri tästä ominaisuudesta.
a) Reaktioyhtälö
| Aine | c alussa mol/l | c tasapainossa mol/l |
| NH3 | x | x – 10–3,70 |
| NH4+ | 0 | 10–3,70 |
| OH– | 0 | 10–3,70 |
c) c(HCl) = 0,10 M ja n(HCl) = 0,00121
mol
V(HCl) = 0,00121 mol : 0,10 M = 0,0121 l = 12
ml
7. a)
Tislauslaitteistoon tarvitaan kolvi 1, johon kiinnitetään
tilausosa 5. Sen sivuputkeen liitetään jäähdytin
4 (Liebig-jäähdytin) ja yläosaan lämpömittari
3. Jäähdyttimen toiseen päähän
kiinnitetään tislausosa 8 ja tisleen keräystä varten
kolvi 2 tai keitinpullo 7. Tislauslaitteisto ei saa olla
täysin umpinainen: osassa 8 on sivulla ilma-aukko.Lisäksi
tarvitaan kuumennukseen haude tai kaksi erilaista haudetta (ei avotulta,
sähköhaude ei ole suositeltava eetterin tislaamiseen).
Kiehumakiviä lisätään tislattavaan seokseen kolviin
1. Tisleelle olisi hyvä olla jäähdytyshaude, jotta
haihtuminen olisi vähäistä.
Kuvan numerot liittyvät tehtävässä
annettuun
välinevalikoimaan.
b) Ensimmäisenä kiehuu eetteri. Eetterin tislautuessa lämpömittari näyttää 35 °C. Isobutyylikloridin tislautuessa lämpötila on 69 °C, sitä alempana kiehuva tisleosuus hylätään. Keräysastia vaihdetaan, kun lämpötila asettuu 69 °C:een. Tislauksen kestäessä tislausosassa (5) on sekä höyryä että nestettä, joka valuu alas seinämiä ja pisaroi hiljalleen lämpömittarin kärjestä.
Keräysastia vaihdetaan vielä lämpötilan alkaessa kohota yli 69 °C:n.
Tislaus lopetetaan, kun tislattavaa seosta on kolvissa vielä tilkkanen jäljellä ja lämpötilan alkaessa jälleen nousta. Koko tislauksen ajan kiehuminen pidetään tasaisen kohtuullisena. Liikaa kuumentamista on varottava.
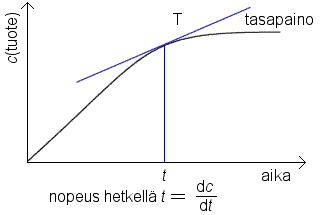
Reaktion nopeus voidaan määritellä lähtöaineen tai tuotteen konsentraatiossa tietyllä aikavälillä tapahtuvana muutoksena. Konsentraation sijasta on mahdollista käyttää ainemäärää tai mooliosuutta.
Reaktion nopeutta on ajateltava myös hiukkasten tasolla, koska kemiallinen reaktio tapahtuu hiukkasten välisten törmäysten seurauksena. Reaktion nopeus on sitä suurempi, mitä enemmän suotuisia törmäyksiä tapahtuu (suotuisa: suunta oikea ja törmäys riittävän voimakas).
Tehokas sekoittaminen lisää hiukkasten törmäyksiä, samoin aineen hienojakoisuus, joka tekee aineen pinta-alan suureksi (huom. pölyräjähdykset). Kaasun paineen lisääminen on itse asiassa konsentraation kasvattamista, sillä paineen lisäämiseen tarvitaan vakiotilavuudessa ainemäärän kasvattamista tai ainemäärän pysyessä vakiona tilavuuden pienentämistä.
Lämpötilan kohotessa reaktionopeus yleensä kasvaa nopeasti ja madaltuessa pienenee. Tällähän on mm. meille kaikille tuttu käytännön merkitys: pakastaminen saa elintarvikkeiden pilaantumisreaktiot hidastumaan mutta lämpimässä edistää pilaantumista.
Katalyytti nopeuttaa reaktiota. Katalysoidussa reaktiossa syntyy aktivoitunut kompleksi katalyytin ja reagoivan yhdisteen välille. Katalyytti vaikuttaa reaktion mekanismiin ja aktivoitumisenergiaan. Jos kyseessä on tasapainoreaktio, katalyytti nopeuttaa sekä etenevää että palautuvaa reaktiota.
Liuotin vaikuttaa varsinkin orgaanisissa synteeseissä reaktion edistymiseen ja voi suosia jotakin tiettyä reaktiomekanismia.
Eliöissä entsyymien selektiivisyys on keskeinen reaktioita ohjaava tekijä, mutta myös keskenään kilpailevien reaktioiden erilainen reaktionopeus kuuluu eliöiden tärkeisiin ohjausjärjestelmiin.
Esimerkki
Lämpötilan reaktioita
nopeuttava ja hidastava vaikutus on johtanut eliökunnassa kylmäkauden
aikaiseen horrostamiseen ja talviuneen.
Vaihtolämpöisillä eläimillä vuorokauden
lämpötilojen vaihtelut heijastuvat suoraan mm. liikkeiden sulavuuteen
tai jäykkyyteen. Eliökunnan tärkein reaktiosarja, fotosynteesi,
tarvitsee tapahtuakseen tietyn lämpötilavälin.
Lämpötilan laskiessa fotosynteesi hidastuu ja kylmässä se
lakkaa kokonaan, kuten myös lämpötilan noustessa liian
korkealle.
Esimerkki
Myös ihmiselimistössä
eri entsyymeillä on erilainen toimintanopeus. Veren pH:n on
pysyttävä hyvin kapealla pH-alueella ( n. 7,3 – 7,4).
Niinpä veressä on useita puskurisysteemejä. Tärkein
näistä puskurisysteemeistä on veren
CO2/HCO3– -pitoisuutta
säätelevä systeemi, jonka toimintaa katalysoi elimistön
nopein entsyymi (karbonianhydraasi). CO2-pitoisuushan voi
muuttua nopeasti hengityksen mukaan, joten nopeus on
elintärkeää.
Esimerkki
Näköaistin toiminnassa on
tärkeää, että solut reagoivat nopeasti
valoärsytykseen. Valo aiheuttaa silmässä hyvin nopean
fotokemiallisen reaktion, jossa cis-11-retinaali muuttuu trans-11-retinaaliksi.
Reaktion seurauksena hermoimpulssi siirtyy näköhermoon.
Trans-11-retinaali palautuu huomattavasti hitaammin takaisin
cis-11-retinaaliksi. Kiirettä ei ole, sillä normaalisti valon osuessa
silmään cis-11-retinaalia jää runsaasti myös
reagoimatta.
Kemian teollisuudessa reaktionopeutta lisätään käyttämällä korkeaa lämpötilaa ja painetta sekä katalyyttejä. Useimmissa raskaan kemian teollisuuden prosesseissa käytetään hyväksi kaasufaasia. Paine voi olla näissä prosesseissa olla niin korkea, että saavutetaan ns. ylikriittinen tila, jossa nesteen ja kaasun ero häviää.
Esimerkki
Typen ja vedyn välinen reaktio,
jossa syntyy ammoniakkia, on huoneen lämpötilassa erittäin
hidas. Lämpötilaa kohottamalla saadaan reaktio kyllä tapahtumaan
nopeammin, mutta silloin myös vastareaktio tapahtuu nopeasti ja ammoniakin
saanto jää vähäiseksi. Näin tapahtuu, koska systeemi
on homogeeninen (kaikki reagoivat aineet ovat samassa faasissa), joten seos
asettuu tasapainotilaan.
Koska ammoniakin muodostumisreaktio on eksoterminen, korkea lämpötila vähentää ammoniakin saantoa (Le Châtelier'n periaate). Saannon lisäämiseksi kohotetaan painetta. Katalyytti on hyvin tärkeä, vaikkei se vaikuta tasapainoseoksen koostumukseen. Nopeuttamalla reaktioita sekä alentamalla aktivoitumisenergiaa katalyytti pienentää prosessin kokonaisenergiankulutusta, millä on suuri taloudellinen merkitys.
Teollisissa prosesseissa reaktion nopeuttaminen onkin useimmissa tapauksissa juuri taloudellinen tekijä. Reaktion hidastaminen jäähdyttämällä tai inhibiitin avulla on sekä taloudellinen että turvallisuustekijä (esim. räjähdysvaaran eliminointi, korroosion tai pilaantumisenesto). Esimerkkinä mainittu ammoniakkisynteesi kuluttaa runsaasti energiaa korkean lämpötilan ja paineen ylläpitämisen takia, joten se erittäin kallis. Se on myös vaarallinen prosessi (räjähdysvaara, ammoniakin myrkyllisyys).
Myös typpihapon ja rikkihapon valmistuksesta osa tapahtuu kaasufaasissa ja normaalia korkeammassa paineessa katalysoituina reaktioina.
Esimerkki
Elottomassa luonnossa
reaktioiden tasaisena pysyvä nopeus on maapallon kehityksen aikana
osaltaan vakauttanut mm. ilmakehän koostumuksen. Esimerkiksi
stratosfäärin otsonikerroksen tasapaino on riippuvainen siitä,
että otsonia muodostuu ja hajoaa samalla nopeudella. Otsonikerroksen
kannalta on kohtalokasta, että sinne on päässyt hajoamista
katalysoivia yhdisteitä, kuten ClO-radikaaleja.
Huomautus tehtävään +8
Tehtävään voidaan vastata monella tavalla (kuten aina
jokereihin). Alussa on syytä selvittää lyhyesti, mitä
kemiallisen reaktion nopeudella tarkoitetaan. Selityksen voisi hyvin aloittaa
suoraan hiukkasten törmäyksistä. Esimerkeiksi teollisista
prosesseista sopivat myös happojen valmistus tai jokin orgaanisen kemian
prosessi, entsyymien teollisesta käytöstä mm. entsyymivalkaisu.
Esimerkkien määrä ei ole ratkaiseva. Reaktionopeuden
merkityksen selventäminen esimerkkien avulla on
tärkeämpää.
Asioiden painotus ja esittelylaajuus voi olla myös hyvin erilainen kuin tässä esimerkissä.
Tehtävä osoittautui suosituksi verrattuna jokereiden suosioon yleensä. Vastausten kirjo oli laaja. Pistekeskiarvo oli 3,74 (toiseksi korkein kokeen tehtävistä). Kaksi vastaajaa ylsi täyteen 9 pisteeseen. Yli 6 pisteen vastauksia oli lähes sata.
Yo s96/+8, Katalyysi
Lisätietoa ammoniakkisynteesistä ja typpihapon
valmistuksesta (OPH:n etälukion kemia)
Otsoni