1 | 2 | 3 | 4 | 5 | 6 | 7 | +8 | kysymykset (erilliseen selainikkunaan)
a) Kationi
Kationi on ioni, jolla on
positiivinen sähkövaraus. Se voi muodostua atomista tai
molekyylistä.
| H – e¯ → H+ | Protoni H+ on pienin kationi. Se syntyy vetyatomin menettäessä elektroninsa e¯. |
| Ca – 2 e¯ → Ca2+ | Metalliatomien uloimpien elektronien irrotessa syntyy kationeja. |
| H2O + H+ → H3O+ | Protonin liittyessä vesimolekyyliin syntyy kompleksikationi, oksoniumioni, jossa positiivinen varaus kuuluu koko kompleksille. Muita esimerkkejä kompleksikationeista ovat mm. ammoniumioni NH4+ sekä metallikationien ja niihin liittyneiden ryhmien muodostamat kationit, kuten [Ag(NH3)2]+. |
b) Kiteinen aine
Kiteinen aine on kiinteää ainetta,
joka koostuu säännölliseen kidehilaan järjestyneistä
atomeista, ioneista tai molekyyleistä. Kiteen koko voi vaihdella
samallakin aineella. Esimerkiksi NaCl eli ruokasuola on kiteinen aine, jonka
kiteet rakentuvat ioneista. Sakkaroosin (sokerin) kiteet puolestaan muodostuvat
molekyyleistä. Timanttikiteiden ja metallikiteiden rakenneosina ovat
atomit.
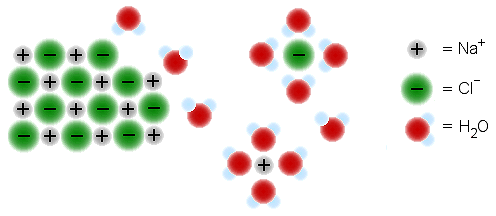
c) Hydratoitunut ioni
Useat ioniyhdisteet liukenevat veteen.
Vedessä ionien ympärille kertyy vesimolekyylejä, koska
vesimolekyylit ovat dipoleja, joita ionien sähkövaraus
vetää puoleensa. Ionien ympärille kertyvien vesimolekyylien
määrä vaihtelee ionin koon mukaan.

d) Pintajännitys
Erilaisten aineiden välisellä
rajapinnalla esiintyvä ilmiö, joka aiheutuu aineiden
rakennehiukkasten sidosvuorovaikutusten erilaisuudesta. Esimerkiksi veden ja
ilman rajalla veden pintaan näyttää syntyvän "kalvo", jolla
kevyet esineet voivat kellua. "Kalvo" johtuu siitä, että
päällimmäisten vesimolekyylin väliset vetysidokset
suuntautuvat toisia vesimolekyylejä kohti, eikä vesimolekyylin ja
ilman molekyylien välille muodostu yhtä vahvoja vuorovaikutuksia.
e) Ideaalikaasu
Ideaalikaasu on fysikaalinen malli, jolla
kuvataan kaasujen yhteisiä ominaisuuksia. Ideaalikaasussa rakennehiukkaset
oletetaan pistemäisiksi eikä niiden välillä katsota olevan
muita vuorovaikutuksia kuin täysin kimmoisia satunnaisia
törmäyksiä. Todellista kaasuista eniten ideaalikaasua
muistuttavat atomeista koostuvat keveimmät jalokaasut helium He ja neon
Ne.
Ideaalikaasun tilanyhtälöä pV = nRT voidaan soveltaa useimmissa tapauksissa todellisiin kaasuihin.
f) Heikko elektrolyytti
Elektrolyytti on aine, joka tuottaa
vesiliuokseen ioneja, jolloin liuos johtaa sähköä. Elektrolyytti
on heikko silloin, kun se ei purkaudu täydellisesti ioneiksi
vesiliuoksessa. Heikot hapot ja emäkset sekä osittain liukenevat
suolat ovat heikkoja elektrolyyttejä.
a) Reaktioyhtälö
b) Reaktioyhtälö
n(HCl) = 0,100 M · 16,1 ml = 1,61 mmol
n((NH4)2SO4) = 0,5 ·
n(HCl)
m((NH4)2SO4) = 1,61
mmol · 0,5 · 132,13 g/mol = 0,1064
g
Prosenttiosuus: 100 % · 0,1064 g : 0,228 g =
46,7 % (46,6 %)
a) Sitruunahappo on kolmiarvoinen karboksyylihappo. Se on heikko happo.
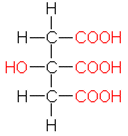
Rakennekaavaa ei vaadittu.
b) Sakariinin makeus on paljon suurempi kuin sakkaroosin, joten sitä on tarpeen lisätä mehuun vain vähän. Vaikka sakariini on hyvin heikko happo ja sen anionin vesiliuos siten emäksinen, mehun pH tuskin muuttuu mitattavissa määrin korkeammaksi (lähtöarvojen tarkkuuden rajoissa).
c) Kun sitruunamehua lämmitetään avoimessa astiassa, mehusta haihtuu vettä ja eteerisiä öljyjä mutta ei sitruunahappoa. Höyry on enimmäkseen vesihöyryä, joka on neutraalia. Huoneilmassa (ja lähellä hengittävän mittaajan uloshengityksessä) on hiilidioksidia, joka saattaa happamoittaa höyryä hieman.
Mutta: Asia olisi toki varmennettava mittauksilla. Edellä esitetyt vastaukset ovat vain hypoteeseja, jotka pohjautuvat niukasti annettuun tietoon puristemehusta, käytetyistä ainemääristä ja lämmitysolosuhteista.
Kommentti ja vertailu MAOLin pisteitysohjeeseen (melko pitkä, uuteen selainikkunaan)
Yhdisteiden A – F rakennekaavat
| a) | d) | 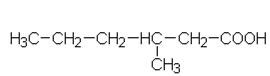 |
|
| b) | 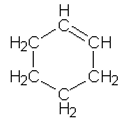 |
e) | 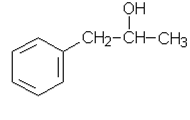 |
| c) | 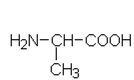 |
f) |
Reaktioyhtälö
pH = 9,70,
V = 150 l
M(Mg) = 24,31 g/mol
M(Mg(OH)2) = 58,32 g/mol
c = n :
V = m : (M V)
pOH = 14,00 – 9,70 = 4,30
[OH–] =
10–4,30 mol/l
KL(Mg(OH)2) =
[Mg2+][OH– ]2 = 1,1 ·
10–11 (mol/l)3
Liukoisuustulon perusteella
laskien näyteliuoksessa on tällöin jäljellä
magnesiumioneja:
[Mg2+] = 1,1 ·
10–11 (mol/l)3 : (10–4,30
mol/l)2 =
Saostumaton magnesium
Mg(OH)2:ksi laskettuna on:
150 l · 0,004379 mol/l
· 58,32 g/mol = 38,3 g
Meriveden
Mg2+-konsentraatio:
c(Mg2+) = 1,34 g/l
: 24,31 g/mol = 0,05512 mol/l
Jos kaikki magnesium saostuisi,
magnesiumhydroksidia saataisiin:
150 l · 0,05512 mol/l
· 58,32 g/mol = 482,2 g
Saostuvaa Mg(OH)2:a on
siis:
482,2 g – 38,3 g = 443,9 g eli 444 g tai 440 g
 |
 |
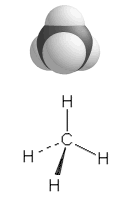 |
| Kp. 100 °C | Kp. –33,4 °C | Kp. –182,5 °C |
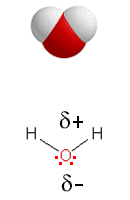
a) Vesimolekyyli H2O on poolinen, koska sen sidokset muodostavat loivan V:n, jonka kärjessä on vetyatomeja elektronegatiivisempi happiatomi. Happiatomilla on kaksi vapaata elektroniparia.
Nestemäisessä olomuodossa vesimolekyylien välillä on vetysidoksia mutta myös muita dipoli-dipoli-vuorovaikutuksia sekä dispersiovoima (van der Waalsin sidoksia). Vetysidokset ovat mainituista vuorovaikutuksista voimakkaimpia ja kukin vesimolekyyli voi sitoa enimmillään neljä muuta vesimolekyyliä vetysidoksin.
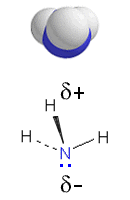
b) Ammoniakkimolekyyli NH3 on poolinen, koska se on muodoltaan hieman epäsäännöllinen tetraedri, jonka keskusatomina on vetyatomeja selvästi elektronegatiivisempi typpiatomi. Typpiatomilla yksi vapaa elektronipari, joka sijaitsee tetraedrin yhdessä kärjessä. Nestemäisessä ammoniakissa sidosvoimat ovat samantyyppisiä kuin vedessä, mutta vetysidoksia voi muodostua vähemmän, sillä ammoniakilla on vain yksi vapaa elektronipari.
c) Metaanimolekyyli CH4 on pooliton, koska hiilen ja vedyn välinen elektronegatiivisuusero on pieni ja molekyyli on symmetrinen tetraedri. Tetraedrin keskellä on hiiliatomi ja kärjissä vetyatomit. Vapaita elektronipareja ei ole. Nestetilassa metaanimolekyylien välillä esiintyy vain dispersiovoimia (van der Waalsin sidoksia), joten metaanin kiehumispiste jää alhaiseksi verrattuna ammoniakkiin ja veteen .
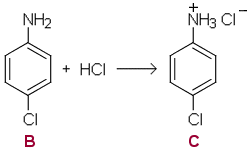
a) Orgaanisen suolan (C) muodostaa 4-kloorianiliini (B).
b) Liuotetaan A:n ja B:n seos ensin dietyylieetteriin, ja siirretään liuos erotussuppiloon. Lisätään erotussuppiloon pieni määrä suolahappoista vesiliuosta. Suppilo ei saa tulla täyteen! Ravistellaan. Ravisteltaessa pidetään erotussuppiloa lähes ylösalaisin. Tulppaa ja hanaa tuetaan kämmenellä. Hanaa raotetaan välillä varovasti suppilossa vallitsevan paineen tasaamiseksi.
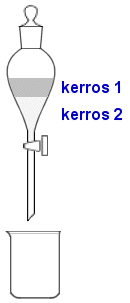
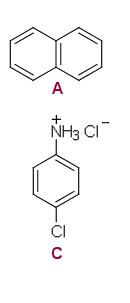
Naftaleeni (A) jää eetterikerrokseen 1 ja 4-kloorianiliinin muodostama suola (C) liukenee vesikerrokseen.
Ravistelun jälkeen suppilo asetetaan tukitelineeseen (mieluiten vetokaappiin eetterin takia), tulppa avataan ja odotetaan hetki kerrosten erottumista. Kun kerrosraja on selkeä, lasketaan alempi vesikerros keräysastiaan. Toistetaan ravistelu muutamia kertoja pienillä vesiliuosmäärillä. Lopuksi eetterikerros valutetaan toiseen keräysastiaan.
Galvaanisen kenno ja sen käytännön sovelluksia
Ainakin seuraavia kohtia on syytä käsitellä: