1 | 2 | 3 | 4 | 5 | 6 | 7 | +8 | kysymykset (erilliseen selainikkunaan)
a) Veden kiehuessa neste muuttuu höyryksi. Nestemäisessä vedessä vesimolekyylien välillä on vetysidoksia, jotka liittävät toisiinsa kaksi tai useampia vesimolekyylejä. Nesteessä sidoksia katkeaa ja muodostuu jatkuvasti molekyylien liikkuessa ja törmäillessä toisiinsa. Kuumennettaessa vesimolekyylien lämpöliike voimistuu, minkä seurauksena vesimolekyylien väliset vetysidokset katkeavat yhä tiheämpään eikä uusia enää muodostu helposti. Niinpä vesimolekyylejä siirtyy kiehuvasta nesteestä ilmaan, jossa ne sekoittuvat ilman kaasumolekyyleihin muodostamatta enää keskenään vetysidoksia (joitakin vetysidoksia tosin saattaa tilapäisesti esiintyä vesihöyryssä).
b) Rauta ruostuu merivedessä eli metallisen raudan Fe-atomit hapettuvat Fe3+-ioneiksi. (Merivesi toimii elektrolyyttiliuoksena.) Fe3+-ionit muodostavat veden ja hapen kanssa ruostetta eli yhdisteen Fe2O3 · H2O.
Tarkemmin yo99s tehtävä +8
c) Sokeri (esim. glukoosi) C6H12O6 on yksinkertainen hiilihydraatti (monosakkaridi), jota hiivasienet käyttävät ravinnokseen hajottaen molekyylin tsymaasientsyymin avulla pääasiassa etanoliksi ja hiilidioksidiksi:
C6H12O6 → 2 C2H5OH + 2 CO2
Reaktio on eksoterminen hapettumis-pelkistymisreaktio.
Sakkaroosi C11H22O11 saadaan myös käytetyksi alkoholiksi, kunhan se ensin hydrolysoidaan. Sokeriliuoksen väkevyys ei saa olla yli 15 %, jotta ensyymit pystyvät toiminaan. Käymisessä syntyy myös muita tuotteita kuin etanolia.
a) Reaktioyhtälö
b) Vuorokaudessa hengitetyn ilman tilavuus
V(ilma) =
4,5 l/min · 24 h · 60 min/h = 6 480
l
V(CO2) = 0,034 · 6480 l = 220,32
l
n(CO2) = 1,0 bar · 220,32 dm3
: (0,0832 bar dm3/mol K · 298 K) = 8,89
mol
m(CO2) = 8,89 mol · 44,01 g/mol = 390
g (391g)
c) Reaktioyhtälön mukaan
n(Na2O2) = n(CO2), joten
m(Na2O2) = 8,89 mol · 77,98
g/mol = 690 g (693 g)
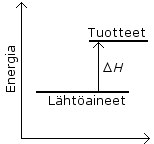
Reaktion energiakaaviosta voidaan päätellä:

a) Reaktiossa sitoutuu energiaa, koska tuotteiden entalpia H on suurempi kuin lähtöaineiden (eli ΔH > 0).
b) Liuos jäähtyy reaktion aikana, koska reaktiossa sitoutuu lämpöä tuotteiden muodostuessa.
c) Kyseinen suola liukenee runsaammin kuumaan veteen, koska lämpöä on silloin enemmän käytettävissä kuin kylmässä vedessä ja suolan liukeneminen on endoterminen tapahtuma (le Châtelier'n periaate).
d) Reaktiolämpöjen avulla ei voida tehdä yleisiä päätelmiä reaktion nopeudesta, koska reaktiolämmöt kertovat reaktioon liittyvistä kvantitatiivista energian muutoksista mutta eivät ajasta, jossa muutokset tapahtuvat. (Koska kuitenkin kyseessä on endoterminen reaktio, on luultavaa,ettei se ole räjähdysmäisen nopea.)
| Yhdiste | Käsite | ||
|---|---|---|---|
| a) | etyyni | 1) | tasomainen rakenne |
| b) | 1,1-dikloorieteeni | 2) | cis-trans-isomeria |
| c) | bentseeni | 3) | poolinen molekyyli |
| d) | pyridiini | 4) | optinen isomeria |
| e) | 2-butanoli | 5) | lineaarinen (sauvamainen) rakenne |
| f) | 2,2-dimetyylipropaani | 6) | aromaattinen hiilivety |
| 7) | heterosyklinen yhdiste | ||
| 8) | tetraedrinen hiiliatomi |
| Rakennekaava Käsite |
Rakennekaava Käsite |
||
|---|---|---|---|
| a) | 5 |
d) | 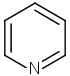 1, 3, 7 |
| b) | 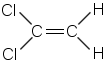 1, 3 |
e) | 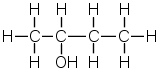 3, 4, 8 |
| c) | 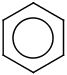 1, 6 |
f) | 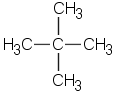 8 |
a) Reaktio
Reaktioon osallistuu vain kaasuja. Reaktioyhtälössä on sekä tuotteita että lähtöaineita yhtä monta molekyyliä, joten reaktio on ilmeisesti riippumaton reaktioastian tilavuudesta. Tasapainovakion lausekkeen avulla perusteltuna:
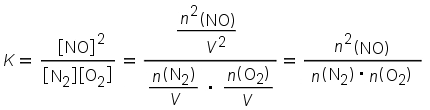
Reaktioastian tilavuus V supistuu lausekkeesta pois ja jäljelle jäävät tasapainoseoksen komponenttien ainemäärät.
b) Lasketaan seoksen lähtötilanteen ainemäärät
| Aine | M g/mol | m g | n mol |
| N2 | 28,0 | 1,0 | 0,0357 |
| O2 | 32,0 | 1,0 | 0,0313 |
| NO | 30,0 | 1,0 | 0,0333 |
Sijoitetaan ainemäärät tasapainovakion
lausekkeeseen:
Q = 0,03332 : (0,0313
· 0,0357) = 0,992 > K = 0,090, joten reaktiossa syntyy
lähtöaineita. Reaktio kulkee käänteiseen (palautuvaan)
suuntaan.
c) Kemiallinen reaktio noudattaa aineen häviämättömyyden lakia, joten suljetussa reaktioastiassa on sama massa ainetta sekä alussa että tasapainon asetuttua.
ρ = m : V = (1,0 g + 1,0 g + 1,0 g) : 0,25 l = 12 g/l eli 0,012 g/cm3
Vertaa yo01k tehtävä 1 c:n ratkaisu
Tiheyden voi laskea myös selvittämällä ensin tasapainoseoksen koostumuksen. Se on kuitenkin turhan työlästä!
a) Rasvat ovat triglyseridien seoksia. Triglyseridit ovat estereitä, joiden alkoholikomponenttina on glyseroli. Glyserolin kaikki kolme OH-ryhmää ovat esteröityneet rasvahappojen kanssa. Rasvahapot ovat pitkäketjuisia monokarboksyylihappoja, tavallisimmin steariini-, palmitiini- ja öljyhappoja.
| Steariinihappo | CH3(CH2)16COOH |
| Palmitiinihappo | CH3(CH2)14COOH |
| Öljyhappo | CH3(CH2)7 CH=CH(CH2)7 COOH |
Triglyseridien esterihydrolyysi saadaan tapahtumaan lähes täydellisesti keittämällä niitä seoksessa, jossa on natrium- tai kaliumhydroksidia (NaOH, KOH) vähintään yhtä suuri ainemäärä kuin triglyseridejä. Esterin hydrolysoituessa vapautuu sekä glyserolia että rasvahappoja. Emäs neutraloi vapautuvat rasvahapot, joten reaktion tasapaino siirtyy tuotteiden suuntaan. Neutraloitumisreaktiossa syntyneitä karboksyylihappojen Na-suoloja sanotaan saippuaksi. Vastaavista kaliumsuoloista käytetään nimitystä suopa.
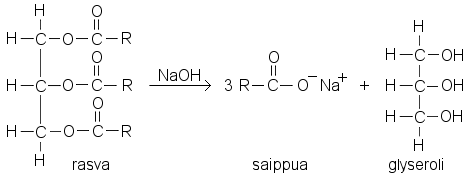 |
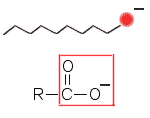
R tarkoittaa pitkää hiilivetyketjua. R ei välttämättä ole sama kaikissa happokomponenteissa, joten hydrolyysissä voi syntyä R:stä riippuen erilaisia anioneja.
Kun hydrolyysi on tapahtunut, saippua "ulossuolataan" liuoksesta eli saostetaan lisäämällä natriumkloridia (NaCl).
Mainintaa saostusmenettelystä ei vaadittu, ei myöskään reaktioyhtälöä (2 pistettä koko kohdasta!).
b) Kun saippua liukenee veteen, rasvahapon suolasta irtoavat kationi (Na+) ja anioni RCOO–. Näistä anioni toimii tensidinä eli pesevänä ainesosana. Sen pesuvaikutus perustuu siihen, että pitkä hiilivetyosuus anionissa on pooliton ja poolisuus on keskittynyt anionin pään karboksyyliryhmään. Poolinen pää suuntautuu vettä kohti, koska vesimolekyylit ovat poolisia, pooliton osuus taas suuntautuu poolittomia aineita, kuten rasvatahran triglyseridimolekyylejä kohti.
 |
 |
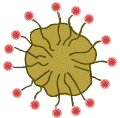
| Likahiukkanen saippuan anionien ympäröimänä. |
Saippuan anioni |
Kuviossa rasvatahraan (kellertävä alue) on kulkeutunut saippuan anioneja. Ne ovat suuntautuneet poolittomalta osuudeltaan rasvatahran sisään. Poolinen pää on tahran ulkopuolella. Näin syntyy ulkopinnaltaan poolinen alue, josta irtoaa likahiukkasia vesimolekyylien pommituksen seurauksena. Likahiukkasen ympärille kertyneet anionit muodostavat negatiivisesti varautuneen kerroksen hiukkasen ympärille. Näin syntyy miselli, joka pysyy liuoksessa vesimolekyylien kertyessä sen ympärille. Misellit huuhtoutuvat veden mukana pois pestävästä kohteesta.
a) Kvartsihiekka ja NaCl
NaCl liukenee
hyvin veteen, mutta kvartsihiekka on liukenematonta. Niinpä NaCl
liuotetaan veteen. Hiekka suodatetaan ja pestään hyvin. Suodoksesta
haihdutetaan vesi, jolloin kiinteä NaCl jää jäljelle.
b) Vesi ja asetoni
Asetoni (propanoni) liukenee veteen
mutta kiehuu paljon alemmassa lämpötilassa (n. 56 °C, 57 °C,
taulukkokirjan painovuodesta riippuen) kuin vesi (100 °C). Asetoni ja vesi
voidaan siis erottaa tislaamalla (mikäli seoksessa määrät
ovat kohtalaisia). Asetoni on hyvin helposti haihtuvaa ja syttyvää
nestettä, joten tislauksessa ei käytetä avotulta. Kuumennus voi
tapahtua sähköhauteessa ja koko tislaus mieluiten vetokaapissa.
Tisleen keräysastiaa on jäähdytettävä liian
haihtumisen estämiseksi. Jäähdytykseen käy esim.
jää-vesihaude. Lämpötilan pysyessä n. 56 °C:ssa,
tislautuu asetonia. Lämpötilan kohotessa saadaan fraktio, joka
sisältää sekä asetonia että vettä.
Tämän jälkeen tislautuu vesi, kun lämpötila nousee 100
°C:een.
c) Typpi ja rikkidioksidi
Typpi ei reagoi helposti
eikä liukene suuressa määrin veteen. Rikkidioksidi
SO2 puolestaan liukenee veteen ja reagoi veden kanssa muodostaen
happoa. Jos molempia kaasuja ei haluta puhtaina, voidaan SO2
absorboida emäksiseen vesiliuokseen, jonka kanssa se myös osittain
reagoi. Typpikaasu on tarpeen kuivata kaasuseoksen kuljettua absorptioliuoksen
läpi. (SO2-kaasu saadaan vapautetuksi liuoksesta
tekemällä liuos happamaksi ja kuumentamalla.)
Ainakin seuraavia asioita olisi hyvä käsitellä
Taulukkokirjasta on tämän vastauksen rakentamisessa suurta apua.
Vertaa OPH:n etälukion jaksollinen järjestelmä-osioon (omaan ikkunaansa)