
1 | 2 | 3 | 4 | 5 | 6 | 7 | +8 | kysymykset (erilliseen selainikkunaan)
 |
| Selvennä etiketti! |
a) Talousvedessä (vesijohto- ja kaivovedessä) on aina jonkin verran kalsium- eli Ca2+-ioneja. Ilmassa taas on hiilidioksidia CO2. Vesijohtoveteen voidaan myös varta vasten lisätä hiilidioksidia. Näiden aineiden reagoidessa keskenään vedessä syntyy liukoista kalsiumvetykarbonaattia Ca(HCO3)2(aq), joka vähitellen hajoaa esimerkiksi vettä keitettäessä tai veden pH:n muuttuessa putkistossa tai käyttöastiassa. Hajoamistuotteena syntyy kiinteää kalsiumkarbonaattia CaCO3(s), joka saostuu laitteiden pinnoille. Tällaista saostumaa sanotaan kattilakiveksi. Kattilakivi ei ole aivan pelkkää kalsiumkarbonaattia, vaan siihen on tavallisesti takertunut mukaan muita veteen joutuneita epäpuhtauksia (esim. ilmakostuttajissa ja kahvinkeittimissä pölyä).
b) Fosforihappo ja sitruunahappo liuottavat
CaCO3-saostuman: syntyy liukoisia suoloja mm.
kalsiumdivetyfosfaattia Ca(H2PO4)2 (kaavaa ei
tarvinnut mainita) ja vapautuu hiilidioksidia. Sitruunahapon
tehtävänä on osaltaan huolehtia riittävästä
happamuudesta. Tensidit puolestaan irrottavat
orgaanista likaa ja pitävät likahiukkaset (myös mahdolliset
kattilakiven pikku muruset) liuoksessa eli emulgoivat likaa ja stabiloivat
syntyvän emulsion. Tensidi on anioni tai molekyyli, jossa on poolinen ja
pooliton osa. Pooliton osa tunkeutuu orgaanista likaa
sisältävään hiukkaseen
(kts.
tehtävä 6)
c) Polyeteeni [–CH2–]n koostuu hiilestä ja vedystä, joten polyeteeniastia voidaan hävittää polttamalla. Täydellisen palamisen tuotteina syntyy hiilidioksidia ja vettä.
Muoviastioiden (HD-polyeteenin) polttaminen kotioloissa ei kuitenkaan ole suositeltavaa, sillä palamista on tavallisessa tulisijassa vaikea saada tapahtumaan riittävän tehokkaasti. Muovi sulaa. Sulanut möykky palaa huonosti: syntyy savua ja nokea, koska lämpötila jää usein liian matalaksi eikä hapen saanti ole riittävää. Asiaa auttaa, jos tulisija on jo kuuma, muovia on vain vähän ja sen seurana on runsaasti hyvin palavaa puuta. Polyeteenin polttaminen sopivissa energiantuotantolaitoksissa on parempi vaihtoehto, mutta se edellyttää että muovinjätteen keräys on järjestetty.
Koska CO2-päästöjä tulisi rajoittaa, myös tällaiset muovipullot olisi hyvä toimittaa uusiokäyttöön jos mahdollista. Uusiokäyttöä ovat esim. lannoitesäkkien, muovisten kukkaruukkujen yms. valmistus.
a) ja b) Hapetusaste lasketaan olettaen, että yhdisteissä hapen hapetusasteena on –2 ja vedyn +1. Alkuainerikin S hapetusaste on 0 (samoin alkuainehapen O2).
| Reaktio | Hapetusasteen muutos | V2O5 on katalyytti. |
|
| 1. | S + O2→ SO2 | 0 → +4 | |
| 2. | 2 SO2 + O2 → 2 SO3 | +4 → +6 | |
| 3. | SO3 + H2O → H2SO4 | Hapetusaste ei muutu. |
c) Rikkihappoa voi syntyä korkeintaan yhtä suuri ainemäärä kuin rikkiä on käytettävissä. Reaktiossa 1 kuluu yhtä suuri ainemäärä happea ja rikkiä. Reaktiossa 2 hapen ainemäärä on puolet rikin ainemäärästä. Kaikkiaan happea tarvitaan siis 1,5 kertaa rikin ainemäärä.
n(H2SO4) = n(S) = 2,5
· 106 g : 32,06
g/mol
m(H2SO4) = ( 2,5 ·
106 g : 32,06 g/mol) · 98,01
g/mol
m(H2SO4) = 7,64 ·
106 g = 7,6 tn
n(O2) = 1,5 ·
n(S)
m(O2) = 1,5 · ( 2,5
· 106 g : 32,06 g/mol) · 32,00
g/mol
m(O2)= 3,74 · 106 g =
3,7 tn
d) Kalsiumfosfaatin ja rikkihapon välisessä reaktiossa syntyy kalsiumdivetyfosfaatin lisäksi kalsiumsulfaattia.
a) Reaktioyhtälö
b) Reaktioyhtälön mukaan hiilidioksidin ja bariumhydroksidin ainemäärä on sama.
V(CO + CO2) = 193 ml
n(CO2) =
n(BaCO3) = 1,04 g : 197,34 g/mol
V(CO2) = (1,04 g : 197,34 g/mol) ·
22,4 · 103 ml = 118,1 ml
CO2:n
määrä tilavuusprosentteina: 100 % · 118,1 ml
: 193 ml = 61,2 % (61 %)
c) Kaasun tiheys NTP-olosuhteissa ρ = M : Vm
CO 29 % , CO2 71 %
a) ja b) Hydrauksessa häviää C=C-kaksoissidos sekä aldehydin C=O-sidos, jolloin kummastakin krotonialdehydin isomeeristä syntyy sama alifaattinen alkoholi, 1-butanoli.
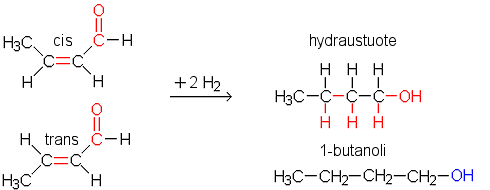 |
c) Kun hapetetaan aldehydiä, saadaan tulokseksi karboksyylihappo. Karboksyylihappo muodostaa esterin 1-butanolin kanssa.
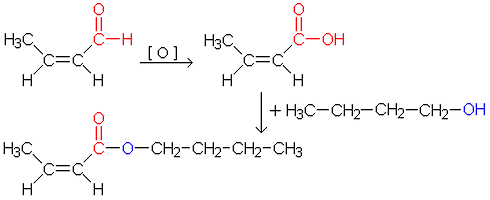 |
 |
a) Kun 0,10 moolia typpihapoketta liuotetaan veteen saadaan liuos, jonka c(HNO2) = 0,10 mol/l.
| Aine | c alussa | c tasapainossa | Yksikkö |
| HNO2 | 0,10 | 0,10 – x | mol/l |
| NO2– | 0 | x | mol/l |
| H3O+ | 0 | x | mol/l |
Ka = [NO2– ]
[H3O+] : [HNO2]
K = x
· x : (0,10 – x) = 4,5 ·
10 –4 (yksikkö mol/l)
Tästä saadaan toisen
asteen yhtälö, josta ratkaistaan konsentraatio
x.
x2 + 4,5 · 10 –4 x
– 4,5 · 10 –5 = 0
Yhtälön
toinen juuri on negatiivinen, joten se ei kelpaa ratkaisuksi. Positiivinen
juuri on x = 0,00649
[NO2– ] =
0,0065 mol/l
Prosenttisosuus: 100 % · 0,0065 mol/l :
0,10 mol/l = 6,5 %
b) Kun liuokseen lisätään natriumnitriittiä NaNO2, liuoksen nitriitti-ionin konsentraatio kasvaa. Le Châtelier'n periaatteen mukaisesti typpihapokkeen protolyysitasapaino siirtyy vasemmalle ja oksoniumionin konsentraatio pienenee. Tästä seuraa, että pH-arvo kasvaa.
Samanlainen liuottaa samanlaista, "similia similibus solvuntur" oli jo alkemisteille tuttu kokemukseen perustuva sääntö, jota voidaan selittää yhdisteiden sidosrakenteen, poolisuuden ja poolittomuuden pohjalta.
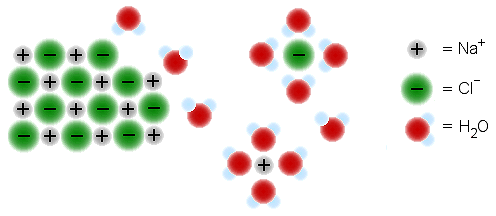 |
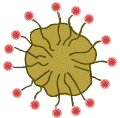
| Kuvassa NaCl liukenee veteen ja hydratoituminen alkaa. Pooliset vesimolekyylit pommittavat kidehilaa ja kerääntyvät ionien ympärille. Vesimolekyyli kääntää happipään kationia kohti ja vetyatomit anionia kohti. |
| Kevät 2001, tehtävä 1 f |
Esimerkki 1
Vesi on pienimolekyylinen
poolinen yhdiste, joka liuottaa hyvin monia ioniyhdisteitä, mm.
ruokasuolaa NaCl, sekä poolisia molekyyliyhdisteitä, kuten
pienimolekyylisiä alkoholeja, mm. metanolia ja etanolia. Myös
sokerit, etenkin mono- ja disakkaridit liukenevat veteen useiden poolisuutta
lisäävien OH-ryhmiensä ansiosta.
Vesimolekyylien ja liukenevan yhdisteen väliset hallitsevat vuorovaikutukset ovat tyypiltään samanlaisia ja siksi myös vahvuudeltaan samaa luokkaa: dipoli-dipoli-, ioni-dipoli-vuorovaikutuksia ja vetysidoksia. Myös dispersiovoimat (van der Waalsin voimat) ovat mukana, mutta dipoliset vuorovaikutukset ovat huomattavasti niitä voimakkaampia. Dipoliset vuorovaikutukset syntyvät pysyvien dipolien ja ionien välille.
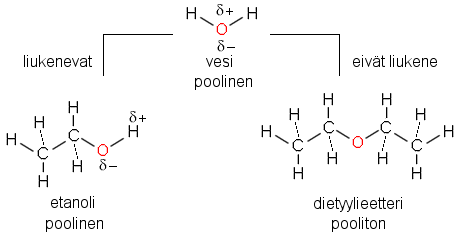
Esimerkki 2
Poolittomat yhdisteet, kuten
rasvat, liukenevat tuskin lainkaan veteen, mutta sen sijaan ne
liukenevat hyvin poolittomiin liuottimiin, kuten bensiiniin
(hiilivetyseos) tai eetteriin. Näihin liuottimiin taas
esimerkissä 1 mainitut pooliset yhdisteet eivät liukene.
Esimerkki 3
Vesi ja eetteri eivät liukene
toisiinsa juuri lainkaan, joten niiden seoksesta erottuu kaksi kerrosta.
Tätä ilmiötä voidaan käyttää hyväksi
uutettaessa erityyppisiä aineita.
Poolittomien molekyylien väliset vuorovaikutukset ovat dispersiovoimia, jotka syntyvät elektronien liikkeestä ja ovat hetkellisiä. Ne riittävät keskenään samantyyppisten molekyylien sekoittumiseen, mutta eivät pysty kilpailemaan poolisten yhdisteiden välisten voimakkaiden vetovoimien kanssa. Tämän takia pooliset molekyylit liittyvät yhteen ja erottuvat omaksi kerroksekseen.
Esimerkki 4
Huonosti toisiinsa liukenevat aineet,
kuten öljy ja vesi, voidaan saada kolloidiliuokseksi emulgaattorilla eli
aineella, jonka molekyylissä tai ionissa on sekä poolinen
pää ja riittävän suuri pooliton osuus. Pooliton osa kiinnittyy liuotettavaan poolittomaan
molekyyliin. Tällainen kolloidi ei kuitenkaan ole varsinainen liuos
eikä yleensä pysyvä. Esimerkiksi maito on kolloidi, jossa
emulgaattoreina toimivat maidon valkuaisaineet.
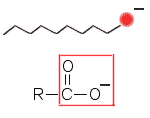
 |
Likahiukkanen
saippuan anionien ympäröimänä
(vasemmalla). Saippuan anioni (oikealla). R on politon osa. |
 |
| Syksy
2001, tehtävä 6b Tämän kokeen tehtävä 1 b |
Emulgointi on myös pesutapahtumassa oleellinen. Emulgaattoreina ovat saippuan anionit tai synteettisten pesuaineiden tensidit.
a) Rakennekaavat
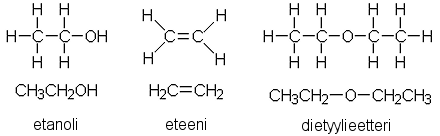 |
| Kaavoista voi saada yhteensä 1 pisteen. |
b) Työturvallisuus
|
 |
 |
 |
||
| Muihinkin kuin edellä mainittuihin seikkoihin voidaan kiinnittää huomiota. Pisteitä annettaessa b-kohdan osuus voi olla enintään 3 pistettä. | ||
| Laitteistokuva suurempana | ||
c) Kolvista tuleva kaasuseos johdetaan NaOH-liuokseen. Kaasuista itse tuote eli eteeni ja orgaaninen epäpuhtaus eli dietyylieetteri eivät sanottavasti liukene emäksiseen vesiliuokseen. Sen sijaan rikkidioksidi SO2 ja hiilidioksidi CO2 reagoivat NaOH:n kanssa, koska ne ovat happamia oksideja. Tuotteena syntyy natriumsulfiittia ja -karbonaattia.
d) Natriumkloridi NaCl ei ota kidevettä, joten se ei sovi kuivausaineeksi. Kuparisulfaatti CuSO4 · 5 H2O sisältää jo maksimimäärän kidevettä, joten se ei pysty kuivaamaan eteeniä. Kidevedetön kalsiumkloridi CaCl2 pystyy ottamaan kaavayksikköä kohti 2 – 6 kidevesimolekyyliä, joten se soveltuu kuivaukseen.
Sidosten muodostuminen tulisi kuvata lyhyesti. Muutamin sanoin voisi kertoa myös aluksi, mitä sidoksen vahvuudella tarkoitetaan.
Aineiden omaisuuksien selittämien sidostyypin perusteella: mm. metallien sähkönjohtavuus, timantin kovuus, veden korkea kiehumispiste, jään rakenne, typen "passiivisuus", proteiinien rakenne jne.
Huom! Tehtävän 6 liukenemisasia sivuaa jokerin aihepiiriä, joten sieltäkin voinee poimia esimerkkejä (dispersio- ja dipolivuorovaikutukset) viittauksina, jos on siihen vastannut.