| Reaktio 1 | 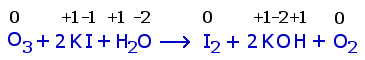 |
||
| Reaktio 2 | 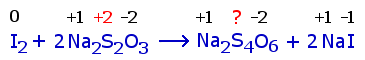 |
||
n = cV
c(Na2S2O3) = 0,15 M
V(Na2S2O3) = 11,2 ml
n(O3) = 0,5 · n(Na2S2O3) = 0,5 · 0,15 M · 11,2 ml = 0,84 mmol
M(O3) = 48 g/mol , m(O3) = 0,84 mmol · 48 g/mol = 0,040 g
1 | 2 | 3 | 4 | 5 | 6 | 7 | +8 | kysymykset (erilliseen selainikkunaan)
a) Täysinäinen virvoitusjuomapullo halkeaa
pakkasessa, koska virvoitusjuoman sisältämä vesi
jäätyy ja jäätyessään laajenee. Laajeneminen johtuu siitä, että
muodostaessaan säännöllisen kidehilan vetysidosten avulla
vesimolekyylit tarvitsevat enemmän tilaa kuin nesteessä, jossa niiden
välillä ei ole säännöllistä vetysidosten
kiinnittämää järjestystä. Jään kidehila
muistuttaa avaruusrakenteeltaan timantin tetraedrisesti rakentunutta kidehilaa,
kun hiiliatomien paikalle ajatellaan vesimolekyylit.
Vrt. Yo 98 k tehtävä 1
b) Muurilaasti sisältää kalkkia eli
kalsiumhydroksidia Ca(OH)2, joka reagoi ilman hiilidioksidin
CO2 kanssa. Tuloksena syntyy kalsiumkarbonaattia CaCO3,
jonka kiteytyessä laasti (mukana hiekkaa, SiO2) muodostaa
yhtenäisen kovan kerroksen.
Vrt. syksy 1996
1.c
c) Kasvin vedenotto perustuu osmoosiin: kasvisolun sisällä olevassa liuoksessa on enemmän liuenneita aineita kuin ulkopuolisessa liuoksessa, jolloin vettä siirtyy puoliläpäisevän solukalvon läpi soluun. Jos merivesi on hyvin suolaista, sen osmoosi kuljettaa vettä solusta pois. Jos merivesi ei ole kovin suolaista, kastelun seurauksena suolaa kertyy kuitenkin vähitellen kasvia ympäröivään maahan ja osmoottinen veden siirtyminen kasviin estyy jonkin ajan kuluttua.
d) Tinassa tapahtuu rakenteen muutos kylmässä, hitaasti jo hieman alle 13 °C, havaittavasti kuitenkin huomattavasti kylmemmässä. Syntyy harmaata, haurasta ja murumaista tinaa, jossa varsinainen metallisidos on purkautunut. Tämä kuvastaa tinan epämetallista luonnetta: tinahan kuuluu samaan jaksollisen järjestelmän ryhmään kuin puolijohde germanium. Tinaesineet siis voivat särkyä, kun niitä säilytetään pitkään kylmässä. Harmaa murumainen aine uudenvuoden tinoissa on juuri tinan epämetallinen muoto. Tinan faasinmuutos tunnetaan arkikielessä myös nimellä tinarutto.
e) Usein väitetään, että amorfisena aineena
lasi valuu vähitellen alas ikkunoissa. On kuitenkin laskettu, että
valuma veisi liian pitkän ajan, jotta sitä olisi ehtinyt muodostua
sinä aikana kun lasin valmistus on osattu. Syynä on
todennäköisesti se, että rakennusmiehet asettivat lasit paksumpi
laita alaspäin ikkunoiden kestävyyden turvaamiseksi. Lasin
valmistustekniikka ei ollut edes vielä sata vuotta sitten kyllin
kehittynyt, jotta vaikeasti käsiteltävästä amorfisesta
lasimassasta olisi saatu tasapaksu levy.
Huomautus
Lisää tietoa ikkunalasista ja
valumisoletuksista
f) Pronssi on metalliseos, joka sisältää kuparia. Kupari reagoi hapen O2, hiilidioksidin CO2 ja kosteuden H2O kanssa muodostaen vihreää patinaa eli "emäksistä kuparikarbonaattia". Reaktio (jota ei vaadita):
Vastaus 11 m3
Ratkaisu
Matkalla Helsinki-Lahti auto kuluttaa
bensiiniä:
110 km · 7,9 l/100 km = 8,69 l
Bensiinin massa:
m = 0,71 kg/l · 8,69 l = 6,71
kg = 6170 g
Bensiinin ajatellaan vastaavan oktaania
C8H18.
Reaktion perusteella n(CO2) = 8 ·
n(C8H18) = 8 · 6170 g : 114,23
g/mol
V(CO2) = ( 8 · 6170 g : 114,23
g/mol ) · 298 K · 0,0832 bar dm3 /mol K
: 1,00 bar
V(CO2) = 10 700 dm3 = 11
m3
a) Yläilmakehän otsonia syntyy ja häviää jatkuvasti UV-säteilyn vaikutuksesta luonnollisessa kierrossa. Kiertoon kuuluva otsonin hajoamisreaktio kiihtyy eräiden ilmaan päästettyjen yhdisteiden toimiessa katalyyttinä. CFC-aineista (freoneista) vapautuvat klooriatomit reagoivat hapen kanssa muodostaen yhdisteen ClO, joka on tehokas katalyytti. Myös bromiatomit, joita irtoaa esimerkiksi metyylibromidista CH3Br voivat osallistua vastaavaan katalyysiin. Ilmakehän pienet jääkiteet toimivat katalyyttien kiinnittymisalustoina. Typpiyhdisteistä dityppioksidin N2O on todettu pystyvän hajottamaan otsonia. Ilmakehän lämpötilaerot ja napa-alueilla muodostuva polaaripyörre vaikuttavat yläilmakehän kemiallisten reaktioiden etenemiseen, mm. edistämällä katalyyttinä toimivien aineiden leviämistä. Vahingolliset aineet pystyvät tuhoamaan otsonia pitkään, koska ne toimivat katalyytteinä eivätkä siksi häviä otsonin hajoamisreaktiossa.
Reaktioyhtälöitä ei vaadittu.
b) Vastaus: 0,040 g. Reaktiossa 1 otsonin happi pelkistyy, ja jodidi hapettuu jodiksi. Reaktiossa 2 jodi pelkistyy jodidiksi ja osa tiosulfaatin rikistä hapettuu. Tetrationaatti-ionissa rikki (?) esiintyy kahdella eri hapettumisluvulla yhteensä +10 : 4. Myös tiosulfaatissa hapettumisluku on vain näennäisesti +2 (toinen S-atomi +6, toinen –2).
Yksityiskohtaisesti
| Reaktio 1 | 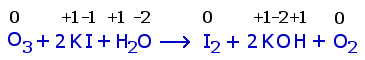 |
||
| Reaktio 2 | 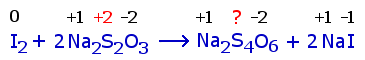 |
||
Lisää tiosulfaatti- ja tetrationaatti-ioneista | Lisää otsoniasiasta (uuteen selainikkunaan)
a) Molempien yhdisteiden synteesissä lähtöaineena Y on todellisuudessa etikkahappoanhydridi(1). Etikkahappo (2) hyväksyttiin myös. (Etikkahappoanhydridiä käytettäessä esteröinnissä ei synny vettä. Etikkahapolla puolestaan esteröinti ei onnistu hyvin.) Kohdassa a ) X on salisyylihappo, tuote on aspiriini.
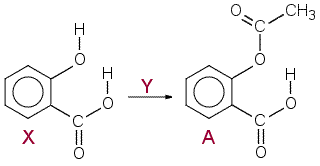 |
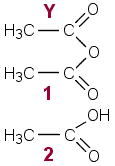 |
b) Z on para-aminofenoli, tuote parasetamoli (nimiä ei vaadita).
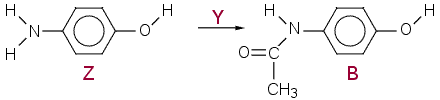
c) Huomaa, että fenolinen (hapan) OH-ryhmä ionisoituu.
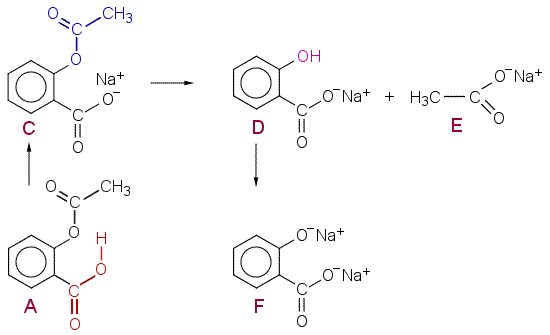
| A | asetyylisalisyyllihappo |
| C | asetyylisalisyylihapon natriumsuola |
| D | salisyylihapon natriumsuola |
| E | etikkahapon natriumsuola |
| F | salisyylihapon dinatriumsuola |
Huomautus | Aspiriinin valmistus (harjoitustehtävä)
Cis-trans-isomeria on mahdollista, jos orgaanisessa
yhdisteessä esiintyy kaksoissidoksia, koska kaksoissidos on
jäykkä eikä päästä hiiliatomeja
kiertymään sidosakseliin nähden.
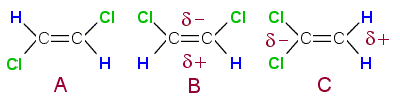
Yhdisteistä ovat
poolisia ne, joissa klooriatomit ovat sijoittuneet selvästi toiselle
laidalle molekyyliä. Kloori on vahvasti elektronegatiivinen ja
vetää sidoselektroneja puoleensa. Sen ympärillä on
myös vapaita elektronipareja, joten elektronitiheys on suuri sen
ympärillä ja klooriatomit muodostavat dipolin negatiiviseen
pään.
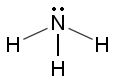
Ammoniakkimolekyylin typpiatomilla on yksi vapaa elektronipari (merkitty kuvaan pisteparilla). Vapaa elektronipari tekee vetysidosten muodostumisen ja protonin sitomisen mahdolliseksi. Puhtaana ammoniakki on kaasu, jonka kiehumispiste on –34,4 °C. Kiehumispiste on suhteellisen korkea verrattuna muihin liki samankokoisista molekyyleistä koostuviin aineisiin, esimerkiksi kokonaan vetysidoksettomaan metaanin CH4, jonka kp on –161 °C.
Veteen verrattuna nestemäinen ammoniakki sisältää kuitenkin vähemmän vetysidoksia, koska typpiatomilla on vain yksi vapaa elektronipari kun taas happiatomilla niitä on kaksi. Ammoniakki on molekyylirakenteensa takia poolinen ja liukenee siksi helposti veteen: sen liukoisuus on 1300 l/1 l H2O (0 °C). Ammoniakin liuetessa tapahtuu osalle molekyyleistä protolyysireaktio:
Ammoniakki on siis emäs (pKb = 1,8 · 10–5 mol/l, heikko emäs), ja vastaavasti syntyvä ammoniumioni NH4+ on happo (pKa = 5,6 · 10–10 mol/l, hyvin heikko happo).
Ammoniakkia valmistetaan teollisesti typestä N2 ja vedystä H2 seuraavan reaktion mukaan Haber-Bosch-prosessilla:
Reaktio-olosuhteet, paine ( 300 - 1000 bar ) ja lämpötila (500 °C) on säädettävä, jotta saalis olisi mahdollisimman suuri. Reaktiossa käytetään kiinteää katalyyttiä, hienojakoista rautaa tai metallikarbideja (heterogeeninen katalyysi). Typpi saadaan ilmasta jakotislauksen avulla. Vetyä tuotetaan öljynjalostuksen sivutuotteena tai kivihiilestä (myös turvetta on käytetty). Suomessa ammoniakin valmistus on lopetettu kannattamattomana vuonna 1992, joten ammoniakki on meillä tuontitavaraa.
Ammoniakkia käytetään typpihapon, urean ja ammoniumnitraatin valmistukseen, sitä tarvitaan myös mm. polyamidien lähtöaineiden tuottamiseen. Alla olevaan taulukkoon on koottu muutamia tärkeimpiä ammoniakista valmistettavia yhdisteitä ja niiden käyttökohteita.
| Yhdiste | Nimi | Käyttökohde |
|---|---|---|
| HNO3 | typpihappo | räjähteet, väriaineet ym. |
| NH4 NO3 | ammoniumnitraatti | räjähteet, lannoitteet |
| H2N–(CO)–NH2 | urea | lannoitteet, muovit |
| H2N–(CH2)6–NH2 | heksametyleenidiamiini | polymamidit |
Tislaus perustuu aineiden erottamiseen toisistaan kiehumislämpötilan perusteella.
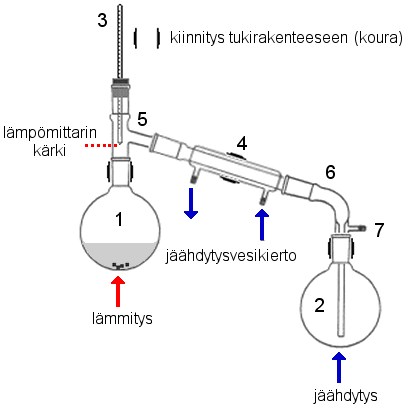
Jäähdytin (4) on liitetty kolveihin tislausosilla (5, 6). Tislausosassa (6) on ilma-aukko (7), johon voidaan tarvittaessa liittää pumppu laitteiston alipaineistamiseksi. Osat 4, 5 ja 6 on mahdollista korvata yhtenäisellä tislaussillalla. |
Tislauksessa tarvitaan kiehumisastia (tislauskolvi 1), usein myös kolonni, josta osa kaasuista tiivistyy takaisin kiehumisastiaan ja osa jatkaa matkaansa jäähdyttimeen (4). Kuvan laitteistossa ei ole kolonnia. Lisäksi tarvitaan lämpömittari (3) ja keräysastia (2), johon tisle kootaan. Jakotislauksessa tarvitaan tietenkin useita keräysastioita eri fraktioille ja hyvin tehokas kolonni. Yhden aineen tislautuessa kiehumislämpötila pysyy vakiona. |
Vrt. k01/7
Teollisia sovelluksia ovat esimerkiksi öljynjalostuksessa käytetty jakotislaus, ilmakaasujen erottaminen nesteytetystä ilmasta ja alkoholin väkevöinti tislaamalla. Öljyn jalostuksessa kerätään tietyillä kiehumispisteväleillä kiehuvat hiilivedyt aina yhdeksi fraktioksi eli jakeeksi. Alimpana kiehuvat pienimolekyyliset hiilivedyt poistuvat seoksesta ensimmäisinä. Kertyvä tisle on hiilivetyseos, kuten esim. moottoribensiini. Ilmakaasujen tislauksessa seoksesta poistuu ensin alemmassa lämpötilassa kiehuva typpi (kp. –196 °C ) sitten korkeammalla kiehuva happi (kp. –183 °C).
Alkoholia (etanolia) ei saada täysin puhtaaksi tislaamalla sitä vesiseoksesta, sillä etanoli ja vesi muodostavat ns. atseotrooppisen seoksen (95 % etanolia, 5 % vettä), joka tislautuu vakiolämpötilassa.
Tislausta käytetään myös lukuisissa orgaanisissa synteeseissä kuten useissa esteröintireaktioissa, joissa tuotteen jatkuva poistaminen reaktioseoksesta siirtää tasapainoa tuotteen puolelle. Myös tislauskolonnissa voi tapahtua kemiallinen reaktio esim. krakkaus, kun käytetään sopivaa täytettä ja katalyyttiä.
Tislauslämpötilaa voidaan alentaa suorittamalla tislaus suljetussa laitteistossa, jossa painetta on pienenetty. Helposti hajoavien yhdisteiden tislauksessa käytetään usein suojan inerttiä kaasua, esim. typpeä.
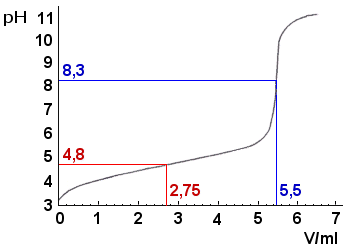
a) Tehtävässä annetulta
titrauskäyrältä luetaan loppupiste eli
kokeellinen ekvivalenttikohta. (Se on titrauskäyrän portaan
keskikohta, jota voidaan etsiä esim. kokeilemalla piirtää
yhdensuuntaiset sivuajasuorat ja etsimällä niille normaali siten,
että käyrän suorien erottamat kolmiomaiset pinta-alat ovat
samansuuruiset. Huomaa, että pH on tässä 8,3. Loppupiste voidaan
määrittää myös ilman apusuoria ). Kohdasta saadaan
NaOH-kulutus V(NaOH) = 5,5 ml. Koska kyseessä on yksiarvoinen
happo, titrauksessa hapon ja emäksen ainemäärä on
loppupisteessä sama. n = cV
c(happo) = c(NaOH)
· V(NaOH) : V(happo) = 0,10 M
· 5,5 ml : 25 ml = 0,022 M
 b)
Happo-emäs-indikaattorit ovat heikkoja happoja tai
emäksiä, joiden happomuoto ja anioni ovat
erivärisiä. Indikaattoria valittaessa on otettava huomioon,
että titrauksen ekvivalenttikohdan pH ja indikaattorin
värinmuutosalueen pH-väli ovat toisiinsa sopivat. Titrauksen
loppupisteen on osuttava likimain värinmuutosalueen keskikohdalle.
Tärkeää on myös värinmuutoksen selkeys, esimerkiksi
fenoliftaleiini on myös sikäli hyvä indikaattori,
että sen happomuoto on väritön ja anioni punainen.
b)
Happo-emäs-indikaattorit ovat heikkoja happoja tai
emäksiä, joiden happomuoto ja anioni ovat
erivärisiä. Indikaattoria valittaessa on otettava huomioon,
että titrauksen ekvivalenttikohdan pH ja indikaattorin
värinmuutosalueen pH-väli ovat toisiinsa sopivat. Titrauksen
loppupisteen on osuttava likimain värinmuutosalueen keskikohdalle.
Tärkeää on myös värinmuutoksen selkeys, esimerkiksi
fenoliftaleiini on myös sikäli hyvä indikaattori,
että sen happomuoto on väritön ja anioni punainen. Fenoliftaleiinin värinmuutosalue on pH-välillä 8,3 - 10. Yhdiste sopii käytettäväksi myös titrattaessa vahvaa happoa vahvalla emäksellä, vaikkei värinmuutos tapahdukaan pH-arvolla 7, sillä muutos on selkeä ja titraus lopetetaan heti punertavan värin jäädessä näkyviin. Fenoliftaleiini sopii heikon hapon titraukseen, koska loppupisteen pH on silloin aina suurempi kuin 7. Heikkoa emästä vahvalla hapolla titrattaessa jokin alemmalla pH-välillä väriään vaihtava indikaattori saattaa olla parempi, esim. metyylipunainen tai bromitymolisininen.
c) Vastaus 1,6 · 10–5mol/l (pKa = pH = 4,8) Tarkkuus vaihtelee sen mukaan, miten käyrää luetaan (pH = 4,9, Ka = 1,3 · 10–5mol/l, MAOL: Ka = 2,0 · 10–5 mol/l, mikä vastaa pH-arvoa 4,7). Kun titrauksen päätepiste on selvitetty, jaetaan kulutus 2:lla ja etsitään kuvaajasta vastaava pH-arvo. Tämä pH-arvo on sama kuin hapon pKa-arvo, koska titrauksen tässä vaiheessa puolet haposta on neutraloitu. Hapon ja sitä vastaavan suolan konsentraatio on silloin yhtä suuri. Titrattaessa heikkoa happoa vahvalla emäksellä syntyy puskurisysteemi, jossa pH = pKa+ log ([suola]/[happo]).
d) 10,0 ml (tai 9,9 ml)
Tarkemmin (vaihtoehto 1)
Tai (vaihtoehto 2)
Ratkaisu: x = l0–2 l = 10,0 ml tai 0,009945 l = 9,9 ml (riippuen siitä, miten käytät likiarvoja)
Vrt. Yo 96 k
tehtävä 7
Huomautus terminologiasta