 |
Luettelossa on 27 tehtävää.
Selvitä, mistä seikoista johtuu, että
a) kulta on tunnettu muinaisista ajoista saakka, rautaa
käytettiin ainakin jo 2500 - 3000 vuotta eKr., mutta alumiinista
tehtyjä esineitä on alettu valmistaa vasta 1800-luvun lopulta
lähtien, b) nykyisin tunnetaan lähes 2000 erilaista
atomia, mutta vain 109 alkuainetta.
Ratkaisu
Ilokaasuna tunnettua dityppimonoksidia voidaan valmistaa hajottamalla ammoniumnitraattia 250 °C:n lämpötilassa:
a) Ammoniumnitraatti on ionirakenteinen yhdiste, jossa typpi esiintyy kahdella eri hapetusasteella. Mitkä nämä hapetusasteet ovat? Mitkä atomit hapettuvat ja mitkä pelkistyvät reaktion aikana? b) Dityppimonoksidi on polaarinen ja lineaarinen molekyyli. Onko atomien järjestys molekyylissä NNO vai NON? Perustele vastauksesi. c) Laske kaasumaisen dityppimonoksidin tiheys normaaliolosuhteissa (NTP). Päättele, onko kaasu raskaampaa vai kevyempää kuin ilma.
Valitse kolme kohtaa seuraavasta luettelosta ja selvitä
näiden kemiallinen perusta:
a) täysinäinen
virvoitusjuomapullo halkeaa pakkasessa
b) muurilaasti kovettuu
ilmassa
c) kasveja ei voida kastella merivedellä
d)
tinaesineitä ei tule säilyttää pitkiä aikoja
kylmässä
e) vanhojen rakennusten ikkunalasit ovat usein
paksumpia alaosastaan kuin yläosastaan
f)
pronssipatsaat saavat helposti vihertävän patinan.
a) Otsonin vähentyminen ylemmissä
ilmakerroksissa on luonnon kannalta haitallinen ilmiö. Mitkä ovat
tärkeimmät kemialliset tekijät, jotka johtavat
otsonikatoon?
b) otsoni on voimakas hapetin ja hapettaa jodidin
jodiksi:
Reaktioita voidaan käyttää otsonin määrän selville saamiseen. Menetelmässä vapautunut jodi titrataan natriumtiosulfaattiliuoksella:
Kuinka monta grammaa otsonia näyte sisälsi, kun titrauksessa
käytettyä 0,15 M natriumtiosulfaattia kului 11,2 ml? Mitkä
aineet hapettuvat ja mitkä pelkistyvät näissä
reaktioissa?
Ratkaisu
Kun fosforia (P4) kuumennetaan vedessä, se
hajoaa fosfiiniksi (PH3) ja fosforihapoksi
(H3PO4). Kirjoita tasapainotettu reaktioyhtälö.
Miten fosforin hapetusluku muuttuu reaktion aikana?
Kuinka monta grammaa fosforia kuluu, kun tuotteiden
kokonaismäärä on 11,8 g?
Ratkaisu
Hapettuminen ja pelkistyminen otettava mukaan vastaukseen.
Vertaa toisiinsa kahta metallista alkuainetta, natriumia ja kuparia.
Tarkastele niiden esiintymistä luonnossa, fysikaalisia ominaisuuksia ja
kemiallisia reaktioita. Miten näitä metalleja voidaan tuottaa
teollisesti, ja mihin niitä voidaan käyttää?
Ohje (ei täydellistä vastausta),
linkkejä
Valitse kolme seuraavista kohdista ja selvitä
näiden kemiallinen perusta:
a) alumiiniset
käyttöesineet yleistyivät vasta 1900-luvulla, vaikka alumiini on
maankuoren yleisin metalli,
b) alumiinista valmistettua "mehumaijaa"
ei suositella käytettäväksi viinimarjamehun valmistuksessa,
c) alumiinikattilaa ei voida puhdistaa natriumhydroksidia
sisältävällä uuninpuhdistusaineella,
d) väkevää typpihappoa voidaan
säilyttää alumiiniastiassa.
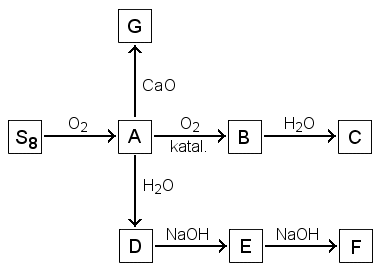
Tarkastele seuraavaa reaktiokaavioita:
 |
a) Esitä yhdisteiden A - G kaavat. b)
osoita, mikä näistä yhdisteistä voi toimia vedessä
amfolyyttinä. c) Kumpi yhdisteitä C ja D voi
toimia sekä hapettimena että pelkistimenä? Perustele.
Ratkaisu
Selvitä esimerkin avulla, mitä eroa on
seuraavilla käsitteillä:
a) puhdas aine ja seos,
b) vahva happo ja syövyttävä happo,
c)
emäs ja emäksinen vesiliuos,
d) amorfinen aine ja kiteinen
aine,
e) galvaaninen kenno ja elektrolyysikenno,
f) isomeeri ja isotooppi.
Ratkaisu
Aineet voidaan sähkönjohtokyvyn perusteella jakaa kolmeen luokkaan: sähköä johtavat aineet, eristeet ja puolijohteet. Miten kemiallisen sidoksen ja aineen rakenteen avulla voidaan selittää aineiden sähkönjohtokyvyn erot?
Ratkaisu – Enemmän sidoksiin liittyvää asiaa!
Kuparia valmistetaan kuparikiisusta, CuFeS2, pasuttamalla malmi ensin oksidiksi ja pelkistämällä oksidi sitten metalliksi. Kokonaisreaktio on seuraava:
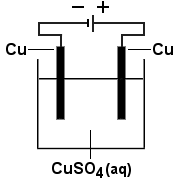
Prosessissa vapautuvaa rikkidioksidia ei voida
sellaisenaan päästää ympäristöön.
a) Pohdi, miten rikkidioksidi voidaan saattaa vaarattomaan muotoon ja miten
sitä käytetään hyväksi kemian teollisuudessa.
b) Saatu kupari puhdistetaan elektrolyyttisesti
käyttämällä epäpuhtaasta kuparista tehtyä anodia
ja puhtaasta kuparista tehtyä katodia. Elektrolyysin aikana anodi liukenee
ja puhdas kupari saostuu katodille. Kirjoita elektrodeilla tapahtuvat reaktiot.
Kuinka paljon kuparia saadaan, kun liuoksen läpi johdetaan 1 500 A:n
tasavirta 1,0 tunnin ajan? Miten kuparisulfaattiliuoksen sininen väri
muuttuu elektrolyysin aikana. Perustele.
Tarkastele oheiseen jaksolliseen järjestelmään kirjaimilla a - h merkittyjä alkuaineita. a) Mitkä näistä eivät muodosta kemiallisia yhdisteitä? b) Mitkä näistä esiintyvät yhdisteissään kationina, jonka varaus on 2+? c) Valitse jokin näistä alkuaineista, jonka oksidi on hapan. Laadi tämän oksidin ja veden välisen reaktion yhtälö. d) Valitse jokin näistä alkuaineista, jonka oksidi on emäksinen. Laadi tämän oksidin ja veden välisen reaktion yhtälö. e) Mikä alkuaineista on voimakkain hapetin? Perustele.
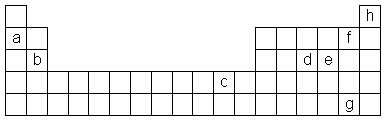 |
Metallien korroosio. Tarkastele korroosiota kemiallisena tapahtumana ja esitä keinoja, joilla korroosiota voidaan vähentää.
Osoita reaktioyhtälöä hyväksi
käyttäen, että
a) kaliumnitraatin
vesiliuos johtaa sähköä,
b) kloori on
voimakkaampi hapetin kuin bromi,
c) amiini on emäs,
d) muurilaasti kovettuu ilmassa.
Ratkaisu
Käytettävissäsi on hopealankaa, kuparilankaa, sinkkilevy ja lyijylevy. Lisäksi saatavilla ovat seuraavien yhdisteiden 1,0 M vesiliuokset: Cu(NO3)2, Zn(NO3)2, AgNO3 ja Pb(NO3)2. Mitä näistä aineista käytät, kun tarkoituksesi on rakentaa mahdollisimman tehokas (suurin jännite) galvaaninen sähkökenno? Perustele. Laadi tässä kennossa tapahtuvien kemiallisten reaktioiden yhtälöt ja esitä piirroksen avulla kennon rakenne.
Selvitä, mitä tarkoitetaan seuraavilla käsitteillä: a) kylläinen liuos, b) elektrolyyttiliuos, c) liuoksen happamuus, d) pooliton liuotin, e) kova vesi, f) hydratoituminen.
Selvitä, mitä kemiallisia muutoksia tapahtuu, kun: a) vesi kiehuu, b) rauta ruostuu merivedessä, c) sokeri käytetään alkoholiksi.
Rikkihappo on maailmassa eniten valmistettu
teollisuuskemikaali. Hapon valmistus perustuu reaktiosarjaan, jossa rikki
hapetetaan ensin rikkidioksidiksi ja edelleen vanadiinioksidin
(V2O5) läsnä ollessa rikkitrioksidiksi. Kun
rikkitrioksidi reagoi veden kanssa, saadaan rikkihappoa.
a) Laadi
prosessissa tapahtuvien reaktioiden yhtälöt.
b) Miten rikin hapetusaste muuttuu reaktioiden aikana, ja
mikä merkitys vanadiinioksidin käytöllä on?
c)
Kuinka monta tonnia rikkihappoa voidaan enintään valmistaa, kun
lähtöaineena on 2,5 tonnia rikkiä? Kuinka paljon happea kuluu?
d) Suurin osa tuotetusta rikkihaposta käytetään
fosforilannoitteiden valmistukseen. Tällöin niukkaliukoinen
kalsiumfosfaatti muutetaan rikkihapon avulla paremmin liukenevaksi
kalsiumdivetyfosfaatiksi. Esitä myös tämän reaktion
yhtälö.
Selvitä esimerkin avulla tai muulla tavoin seuraavat käsitteet: a) kationi, b) kiteinen aine, c) hydratoitunut ioni, d) pintajännitys, e) ideaalikaasu, f) heikko elektrolyytti.
Galvaaninen kenno (galvaaninen pari) ja sen käytännön sovelluksia.
Selvitä reaktioyhtälön avulla tai sanallisesti, mitä tapahtuu, kun
| a) | ruokasuola liukenee veteen, |
| b) | pieni natriumpala pannaan veteen, |
| c) | sinkkijauhetta lisätään suolahappoliuokseen, |
| d) | hopeanitraattia lisätään rauta(II)nitraatin vesiliuokseen, |
| e) | hopealanka upotetaan kuparisulfaatin vesiliuokseen, |
| f) | natriumkloridia ja natriumjodidia sisältävään vesiliuokseen lisätään nestemäistä bromia. |
Selvitä, mitä eroa on seuraavilla käsitteillä:
| a) | epäjalo metalli – jalo metalli |
| b) | vahva happo – heikko happo |
| c) | kiteinen aine – amorfinen aine |
| d) | emäksinen oksidi– hapan oksidi |
a) Laadi rakennekaavat kaikille yhdisteen C4H10O isomeereille. b) Millä näistä isomeereistä esiintyy optista isomeriaa? c) Mitkä isomeereistä reagoivat, kun yhdistettä käsitellään miedolla hapettimella? Laadi hapetustuotteiden rakennekaavat.
Kuvaa jotain yksinkertaista tapaa, jonka avulla voit osoittaa, että
a) etikkahappo on heikko happo,
b) rauta
on epäjalo metalli,
c) kiinteä litiumkloridi
on ioniyhdiste,
d) valkea jauhemainen aine on natriumkarbonaattia.
Jodia voidaan valmistaa rikkihappoliuoksessa seuraavan reaktion mukaisesti:
a) Määritä reaktioyhtälön kertoimet.
b) Käytössä on 159 ml 0;50 M natriumjodidiliuosta ja
2,9 g mangaanidioksidia. Kuinka paljon jodia voidaan enintään saada?
c) Mikä aine toimii reaktiossa hapettimena ja
mikä pelkistimenä?
"Niin, rakas Watson", sanoi Sherlock Holmes, "osoitamme, että murha oli tehty juottamalla uhrille arsenikkia kahvin kanssa. Suoritamme huolellisesti Betterdorffin kokeen todetaksemme kahvijäännöksessä olevan arseenia. Sekoitamme kahvinäytteen väkevään suolahappoon liuotetun tina(II)kloridin kanssa, lämmitämme varovasti kaasuliekillä ja voimme todeta…. aha! …. aivan oikein, liuos värjäytyy ruskeaksi, muodostuu vapaata arseenia!" Reaktio on:
| a) | Määritä reaktioyhtälön kertoimet. (2 p.) |
| b) | Mitkä aineet hapettuvat ja mitkä pelkistyvät reaktiossa? Esitä myös vastaavat hapetuslukujen muutokset. (2 p.) |
| c) | Laadi reaktioyhtälö, kun liuoksessa oleva arseeni esiintyy arseenitrioksidina (As2O3). Lisää tarvittaessa yhtälöön vetyioneja ja vettä. (2 p.) |
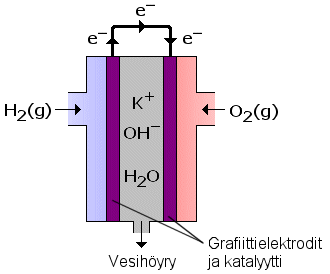
Polttokennon periaate keksittiin jo vuonna 1938, mutta laajamittainen tutkimus- ja kehitystyö alkoi vasta 1980-luvulla. Kioton ilmastosopimus on omalta osaltaan lisännyt eri maiden tutkijoiden ja teollisuuden kiinnostusta polttokennojen kehittämistä kohtaan.
| a) | Mitä polttokennolla tarkoitetaan, ja miksi sen avulla tuotettu sähkö- ja lämpöenergia on ympäristön kannalta parempi vaihtoehto kuin perinteisin menetelmin tuotettu? (4 p.) |
| b) | Oheisessa kaaviossa on esitetty erään polttokennon rakenne. Selosta, miten kuvan polttokenno toimii ja mitä reaktioita sen toiminnan aikana tapahtuu. (5 p.) |